Theorie der neuronalen Schaltung des Gehirns
und des analytischen Denkens
ISBN
978-3-00-037458-6
ISBN 978-3-00-042153-2
Monografie von Dr. rer. nat. Andreas Heinrich Malczan
Kapitel 3: Das limbische System
Gewidmet dem Neurologen
James Papez, dessen Ansicht, die Strukturen des
limbischen Systems wären durch mächtige Bahnen kreisförmig miteinander
verbunden, den Autor zu diesem Teil seiner Monografie inspirierte. Der
vielgelobte,
aber auch vielgescholtene Papez-Kreis ist die informationstheoretische Grundlage
der Signalverarbeitung im limbischen System
Oranienburger Prophezeiung:
Nicht die Computersimulation, sondern der gesunde Menschenverstand kann die Welt
erkennen!
(Andreas Heinrich Malczan - Juni 2013)
Teil 3.1. Ein Exkurs in den Urozean vergangener Epochen
Wagen wir einen Exkurs in eine längst vergangene Zeit, da die ersten tierischen Lebewesen sich anschickten, ihr Futter aktiv zu erbeuten. Eines dieser Urtiere wählen wir für unsere Betrachtungen aus. Um die Anonymität zu durchbrechen, verpassen wir unserem Exemplar kurzerhand den Namen "Friedrich".
Friedrich hatte also Hunger. Er lebte im Urozean, Futter gab es reichlich. Der Urozean war große und tief. Unten war es stockfinster. Friedrich hatte noch niemals Tageslicht gesehen. Dies lag aber nicht an der Dunkelheit. Der Urozean war, speziell in geringer Tiefe und vor allem in den flachen Uferzonen, sehr wohl lichtdurchflutet. Aber damals hatten Tiere noch keine Augen, höchstens einige lichtempfindliche Hautzellen. Damit ließ sich nur hell und dunkel unterscheiden. Sehen konnte man damit aber nicht. Deshalb hatte Friedrich noch nie Tageslicht gesehen, er war blind. Er roch das Futter. Friedrich war kein Pflanzenfresser. Dennoch war er auf die Pflanzenfresser angewiesen, denn diese waren seine Beutetiere. Aber es gab ein Problem. Fast immer, wenn Friedrich eine geeignete Beute gerochen hatte, war diese bereits fortgeschwommen. Denn Tiere konnten aktiv schwimmen. Und es kam noch viel schlimmer: Friedrich hatte die Erinnerung an diese Beute bereits vergessen, kaum dass er sie bemerkt hatte.
Die olfaktorischen Rezeptoren gerieten in Erregung, wenn eine Beute vorbeischwamm. Die Aktionspotentiale wurden in eine Neuronenschicht weitergeleitet, die später als olfaktorischer Cortex bezeichnet wurde. Da die Muskeln bereits damals über Motoneuronen mit dem Transmitter Acetylcholin aktiviert wurden, mussten die Cortexaxone von Glutamat auf Acetylcholin umgeschaltet werden. Dazu diente ein Umschaltkern, der später als Septum bezeichnet wurde. Die im Septum auf Acetylcholin umgeschalteten Signale wurden zu den ihnen zugeordneten Motoneuronen der Muskelgruppen gesendet, die den Vortrieb und die Richtungssteuerung bewirkten.
Natürlich war es sinnvoll, nicht nur die zugehörigen Muskelgruppen zu aktivieren, sondern das gesamte System. Daher findet man noch heute bei den Wirbeltieren entsprechende erregende, cholinerge Projektionen von den Septumkernen einerseits zum Hypothalamus, der auf das vegetative Nervensystem einwirkt, aber auch auf den Nucleus suprachiasmaticus, mit dem die endogene zirkadiane Tagesrhytmik gesteuert wird. Ebenso projiziert das Septum über die Habenula ins Tegmentum zu den monoaminergen Kernen, also zur dopaminergen VTA, zum andrenergen Locus coeruleus und zu den serotonergen Nuclei raphes magnus. Letztere zwei aktivieren mit ihren Transmittern bei Wirbeltieren/Säugern das Vorderhirn. Und noch heute integriert die Habenula die olfaktorischen, septalen und amygdaloiden Signale und leitet sie über den Nucleus dorsalis tegmenti zu den Neuronenkernen für die Kau- und Schluckmuskelatur, die bei erfolgreichem Beutefang aktiviert werden müssen.
Alle diese Systeme sind übrigens doppelt vorhanden, die Arbeitsteilung zwischen linker und rechter Körperhälfte ist evolutionär uralt.
Die Aktivierung der Muskeln und des neuronalen Systems beim Auftauchen von Beute oder Feinden durch deren verräterische olfaktorische Wahrnehmung war also ein Schritt in die richtige Richtung. Solange die Beutetiere oder auch die Angreifer langsam und träge waren, war dies eine gute Strategie. Aber die Evolution tat ihr übriges. Viele Tiere optimierten ihre Systeme, wurden dadurch schneller, entgingen so dem gefressen werden und konnten sich daher massenhaft vermehren. Die schnellen verdrängten die langsamen, die ein Opfer der Fresssucht ihrer Feinde wurden.
Die gewonnene Schnelligkeit erzeugte ein neues Problem. Die Duftwolke einer Beute breitete sich nicht unendlich schnell aus, außerdem nahm die Duftintensität mit der Entfernung zur Beute rasch ab. Eine schnelle Beute konnte daher zeitlich verzögert eine Duftwolke hinterlassen, obwohl sie selbst bereits fortgeschwommen war. Und selbst diese beutefreie Duftwolke verflog rasch infolge der Diffusion. So erhielten die beutesuchenden Tiere nur sehr kurzzeitige Informationen, die sensorischen Rezeptoren stellten ihr Feuern recht bald ein. Dann gab es kein Beutesignal mehr.
Gewiss war die Erhöhung der Empfindlichkeit der Geruchsrezeptoren anfangs die Lösung. Daher entwickelte sich der Geruchssinn zu einem erstaunlich empfindlichen Sinn. Aber die Fluchtgeschwindigkeit der Beutetiere passte sich an die höhere olfaktorische Empfindlichkeit an. Die Beute konnte oft fliehen, bevor man ihrer habhaft werden konnte. Und Ihr Geruchssignal war dann auch recht schnell verschwunden.
Wer nicht verhungern wollte, brauchte also ein Gedächtnis. Eine wie auch immer geartete Schaltung aus Nervenzellen, die ihn daran erinnerte, dass eben eine fette Beute recht schnell vorbeigeschwommen war. Die Erinnerung würde die Verfolgung der Beute ermöglichen oder deren Suche, falls sie sich verstecken konnte. Denn diese aktive Erinnerung würde aktiv Aktionspotentiale erzeugen, die letztlich diejenigen Muskelgruppen ansteuern würden, die der Beuteverfolgung dienten.
Den Input für die Signale lieferte der Geruchssinn. Geeignete Rezeptoren - Riechzellen - erzeugten Aktionspotentiale - wenn die richtige Beute vorbeischwamm. Denn die Beute roch - auch unter Wasser: Die Stoffwechselprodukte im Körper diffundierten teils durch die Außenhaut, teils aus den gierig geöffneten Mäulern der ebenfalls hungrigen Beutetiere und verrieten deren Anwesenheit. Daher war der Geruchssinn so wichtig und so ungeheuer gut ausgeprägt � auch schon vor Urzeiten. Auch für die eigene Fortpflanzung war er enorm wichtig. Sexuelle Lockstoffe, Pheromone genannt, führten bereits in Urzeiten Männlein und Weiblein zusammen und ermöglichten so Sex und Fortpflanzung.
Beute gab es wohl genug damals. Doch Friedrich vergaß die Beute fast sofort, wenn diese vorbeischwamm. Denn die Duftmoleküle verteilten sich rasch in der riesigen Wassermasse des Ozeans. Sobald die Riechzellen nicht mehr feuerten, war das Signal weg und die Beute vergessen. Was tun?
Man musste die Signale vor seinem geistigen Auge wiederholen. In etwa so, wie die vergessliche Hausfrau, die ständig vor sich hinmurmelt: "Kaffee ist alle, Kaffee ist alle", "Kaffee ist alle". Bis sie es endlich auf dem Einkaufszettel notiert hat. Wiederholung war die technische Lösung!
Diese ständige Signalwiederholung realisierte ein neues neuronales Teilsystem, welches als Echogenerator arbeitete. Es erzeugte von jedem Input hinreichend viele Echos, ganz nach dem Prinzip der vergesslichen Hausfrau. Sein Input kam vom olfaktorischen Cortex. Sein Output war zu jedem Input eine Echofolge, in der das Eingangssignal hinreichend oft wiederholt wurde.
Jedes Outputneuron des olfaktorischen Cortex hatte sein eigenes Outputaxon, welches schon damals im Erregungsfalle der Aktivierung der Körperfunktionen über das Septum diente, wenn seine Aktionspotentiale das Vorhandensein von Beute anzeigten. Der Aktivierung bzw. der Deaktivierung der Körperfunktionen stand das vegetative Nervensystem zur Verfügung. Wie aber löste die Natur das Problem der Vergesslichkeit. Welche Art der Wiederholung brachte die technische Lösung? Welche Schaltung realisierte den nötigen Echogenerator?
Die Aktionspotentiale eines jeden Outputneurons des olfaktorischen Cortex wurden zusätzlich je einem neuen Neuron zugeführt, dessen Axon deutlich länger war. Es war quasi ein Umschaltneuron. Die vielen kleinen Umschaltneurone bildeten im Verlaufe der Evolution eine eigene Schicht, in der sie Körnern gleich eingebettet waren. Heute werden sie deshalb als Körnerzellen bezeichnet. Da ihre Axone unmyelinisiert waren, breitete sich jedes Aktionspotential relativ langsam aus, z. B. pro Millisekunde nur einen 0,2 Millimeter. Das macht pro Sekunde 0,2 Meter. In etwa diese Geschwindigkeit erreichen auch heute noch die Aktionspotentiale auf marklosen Fasern. Damals war diese Geschwindigkeit sicherlich kleiner, weil es noch keinen Zwang gab, diese Geschwindigkeit zu erhöhen.
Wenn solch ein Axon eine Länge von zwanzig Millimetern hatte, benötigte ein Aktionspotential für diese Strecke 100 Millisekunden. Es wurde also zeitlich verzögert. Physikalisch gesehen war ein solches Axon eine Verzögerungsleitung für die darauf entlanglaufenden Aktionspotentiale. Zapfte man diese Verzögerungsleitung beispielsweise 40 Mal an unterschiedlichen, etwa gleichabständigen Stellen an, so erhielt man vierzig Echosignale im Abstand von je 2,5 Millisekunden. Zum Anzapfen musste eine neue Neuronengruppe entwickelt werden, die es so vorher nicht gab. Diese vierzig Echos konnte man einem Integrationsneuron zuführen, welches daraus eine neue Signalfolge zusammenstellte, die die vierzig Einzelechos enthielt. Auch dieses Integrationsneuron war eine neue Neuronenart im entstehenden Echogenerator.
Wir werden diese Anzapfneuronen künftig als Echoneuronen bezeichnen. Sie erzeugen durch Anzapfen der Verzögerungsleitung beispielsweise vierzig Echos, die sich auf ein Zeitintervall von 100 Millisekunden verteilen. Diese Echos nennen wir primäre Echos. Aus ihnen entstand durch Zusammenfassung im Integrationsneuron ein sekundäres Echo von deutlich längerer Dauer.
Das war schon ein Zeitgedächtnis von insgesamt einhundert Millisekunden. Denn genau so lange dauerte es, bis das Aktionspotential vom letzten Echoneuron als Output verfügbar wurde. Ein Integrationsneuron fasste die vierzig Einzelechos zusammen und erzeugte so das zeitgedehnte Outputsignal. Dieses war ein sekundäres Echo von beispielsweise 100 Millisekunden Dauer und einer Feuerrate von circa 400 Hz.
Hätte die Ausbreitungsgeschwindigkeit der Aktionspotentiale dagegen nur 0,1 m/s statt der hypothetisch angenommenen 0,2 m/s betragen, so wäre das sekundäre Echo 200 Millisekunden lang. Um allerdings dann auf eine Feuerrate von 400 Hz zu kommen, hätte man die Verzögerungsleitung 80 Mal anzapfen müssen. Doch auch 100 Millisekunden waren besser als nichts. Nun wusste man also noch 100 Millisekunden lang, dass gerade eben eine Beute vorbeigeschwommen war. Und durch die Vervierzigfachung des einen Aktionspotentials wurde man in dieser Zeit auch vierzig Mal an die Beute erinnert. Dies war zwar ein Zeitgedächtnis, aber es war recht kurz.
Tiere, die einen solchen Echogenerator nutzten, erinnerten sich länger an die Beute. Wobei man davon ausgehen kann, dass die Leistungsfähigkeit anfangs gering war. Zunächst war es vielleicht nur ein einziges Echoneuron, aber selbst dadurch verdoppelte sich die Anzahl der Aktionspotentiale auf einen olfaktorischen Reiz gegenüber einem echofreien System. Und mit jedem weiteren Echoneuron, welches die Verzögerungsleitung anzapfen konnte, nahm die Echoanzahl zu. Da jedes Aktionspotential letztlich ein Impuls war, wurde die Impulsanzahl vervielfacht. In der Elektrotechnik bezeichnet man dieses Prinzip ebenfalls als Frequenzvervielfachung. In neurologischen Systemen brachte die Evolution dieses Prinzip bereits vor vielen Millionen Jahren zur Perfektion.
Alle technischen Elemente der beschriebenen Lösung des neuronalen Echogenerators haben heute eigene Namen. Die Axone, die als Verzögerungsleitungen arbeiten, nennt man heute Moosfasern. Die zugehörigen Neuronen werden als Körnerzellen bezeichnet. Jene Axone, die die Einzelechos der Aktionspotentiale schnell zum Integrationsneuron befördern, heißen Schaffer-Kollateralen. Benannt nach dem berühmten Neurologen Károly Schaffer (1864-1939), der vor allem in Budapest wirkte. Die neurologische Struktur dieses Echogenerators im modernen Säugerhirn wird als Hippocampus bezeichnet. Cornu Ammonis der lateinische Name, kurz CA. Das Cornu Ammonis wird in vier Teilbereiche unterteilt, die fortlaufend nummeriert werden. Das Gebiet des Cornu Ammonis, welches die echoerzeugenden Echoneuronen enthält, bezeichnet man als CA3-Region des Hippocampus. Dessen Echoneuronen nennt man CA3-Pyramidenzellen, wegen der pyramidalen Form ihrer Zellkörper. In der CA1-Region dagegen liegen die Integrationsneuronen, die die vielen Einzelechos einer Moosfaser zu einem sekundären Echo vereinen. Diese Neuronen werden daher als CA1-Pyramidenzellen bezeichnet.
Es ist erstaunlich, welchen Interpretationsspielraum die Beschreibung der Schaltung von neuronalen Echogeneratoren bietet. Mathematiker und Elektrotechniker werden sich eine solche Verzögerungsleitung als eine einfache Leitung vorstellen, die an jedem Echoneuron eine kleine Verzweigung bildet. An dieser Verzweigung zapft das Echoneuron diese Leitung an. Jedes Echoneuron besitzt seinerseits eine eigene Outputleitung zum Integrationsneuron, wo die zeitlich versetzten Einzelechos zusammengefasst werden.
Skizze 1: Echogenerator - vereinfachte Darstellung
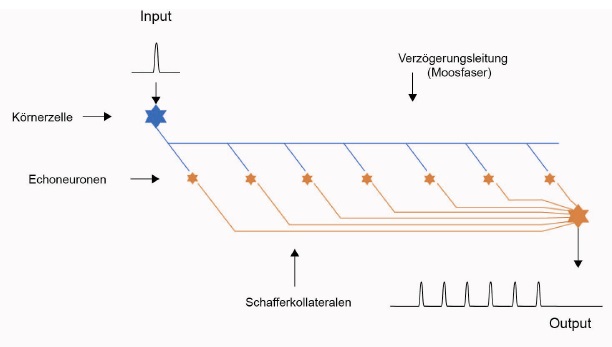
Neurologen werden sich den gleichen Sachverhalt völlig anders vorstellen. Sie wissen, dass die CA3-Pyramidenzellen im Hippocampus recht große Neuronen sind, die (nach der Theorie des Autors) als Echoneuronen arbeiten sollen. Damit diese ein eigenes Aktionspotential bilden, reicht eine einzige Synapse mit der Verzögerungsleitung, also mit der Moosfaser, nicht aus. Deshalb bildet die zugehörige Moosfaser, wie fast alle Axone, ein wahres Axonbäumchen-Geflecht aus, welches die eigentliche Verzögerungsleitung umgibt oder sie gar ganz ersetzt. Dieses moosartige Geflecht, welches auch noch in die Länge gezogen werden muss, weil die Verzögerungsleitung ja gerade wegen ihrer größeren Länge als Verzögerungsleitung wirkt, gab diesen Axonstrukturen im Hippocampus den Namen Moosfasern. Und ein Echoneuron - im Hippocampus eine CA3-Pyramidenzelle - zapft nun mit hunderten (oder tausenden) Synapsen diese verzweigte Axonstruktur an, so dass die damit übertragene Erregung für die Auslösung eines eigenen Aktionspotentials reicht.
Aber auch die Axonleitungen der als Echoneuronen arbeitenden CA3-Pyramidenzellen, die als Schaffer-Kollateralen bezeichnet werden, bilden wiederum eigene Axonbäumchen an den als Integrationsneuronen wirkenden CA1-Pyramidenzellen, deren große verzweigte Dendritenbäumchen mit diesen ebenfalls großen Axonbäumchen unzählige synaptische kontakte bilden. Da diese Schaffer-Kollateralen überaus zahlreich sind und in etwa parallel zueinander verlaufen, bilden sie ebenfalls ein Nervengeflecht, also einen Plexus. Damit verfügen Echogeneratoren über markante Erkennungsmerkmale.
Skizze 2: Echogenerator - realitätsnahe Darstellung
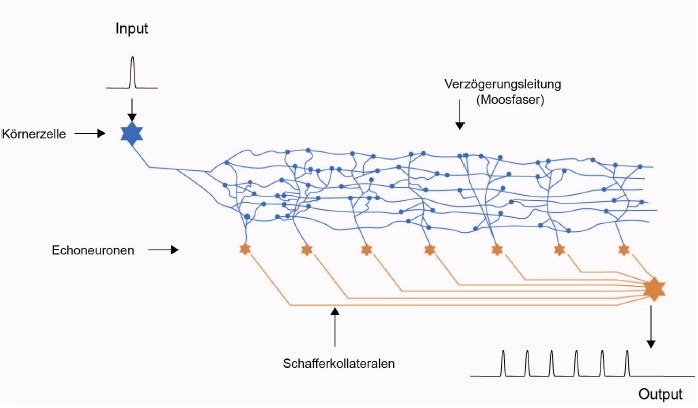
Eine niedrige Ausbreitungsgeschwindigkeit der Aktionspotentiale entlang der Verzögerungsleitung war vorteilhaft, dadurch wurden die Echosignale zeitlich stärker gedehnt. So konnten sich diese Tiere länger an die Beute erinnern, konnte sie länger verfolgen und gewannen den evolutionären Wettbewerb. Nachdem sich dieser Echogenerator bei allen überlebenden Tieren dieser Spezies (also bei den Wirbeltieren) durchgesetzt hatte, war aber der evolutionäre Vorteil dahin. Es herrschte wieder Waffengleichheit. Dennoch waren jene im Vorteil, die die geringere Ausbreitungsgeschwindigkeit auf den Verzögerungsleitungen nutzten und diese so oft wie möglich zur Echobildung anzapften. Eine weitere zeitliche Verlängerung des Beuteechos wäre sinnvoll gewesen. Dann hätte man z. B. eine Beute, die sich verstecken konnte, so lange suchen können, wie die Echosignale aktiv waren. Denn deren Aktionspotentiale steuerten z. B. über das Septum die Muskeln an. Technisch war dies aber schwierig. Um eine Echolänge von beispielsweise einer Sekunde zu erreichen, hätten die Verzögerungsleitungen eine Länge von zwanzig Zentimetern haben müssen. So lang waren damals nicht einmal die Tiere selber. Oder lässt sich angesichts dieser Erkenntnis der in früher Evolutionszeit nachweisbare Riesenwuchs einiger teils recht primitiver Lebensformen des Urozeans erklären? Größerer Körper = längere neuronale Verzögerungsleitungen, diese Formel ging letztlich nicht auf, denn mit wachsender Körperlänge wuchs das Volumen in der dritten Potenz, der Wasserwiderstand und somit der Energiebedarf stiegt exponentiell an und war irgendwann nicht mehr zu befriedigen.
Wie also konnte das Zeitgedächtnis dennoch vergrößert werden, so dass die Erinnerung an eine Beute nicht nach Bruchteilen von einer Sekunde verschwand?
Ein technischer Trick half hier weiter. Man konnte ja den Output des Integrationsneurons wieder als Input benutzen. Die olfaktorischen Rezeptoren gerieten in Erregung, wenn eine Beute vorbeischwamm. Die Aktionspotentiale wurden vom Cortex auf die Verzögerungsleitung geschickt. Diese wurde von den Echoneuronen möglichst oft angezapft. Die angezapften Echos wurden auf besser myelinisierten, also -schnelleren- Axonleitungen einem gemeinsamen Integrationsneuron zugeführt. Ein weiteres, neues Neuron - das Rücksendeneuron - nahm diese Signale in Empfang und leitete sie mit seinem myelinisierten Axon schnell wieder an den Anfang der Schaltung, also zurück zum olfaktorischen Cortex bzw. zur zugehörigen Körnerzelle. So schloss sich der Kreis. So etwas nennen Physiker heutzutage Rückkopplung. Zurückführung des Inputs an seinen Entstehungsort. Elektronische Schwingkreise funktionieren so. Noch heute!
Skizze 3: Erzeugung von Dauerschwingungen durch Rückkopplung
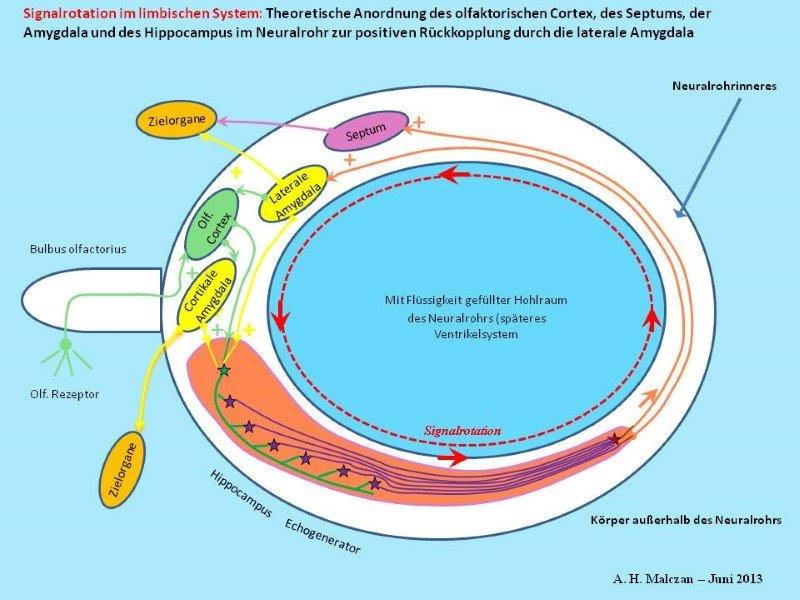
Grundlage der Entstehung einer Schwingung ist die erregende, also positive Rückkopplung des Outputs zum Input. Dann kann ein einmaliger Anstoß durch ein Inputsignal eine Dauerschwingung, also eine Oszillation bewirken. Im limbischen System entsteht eine solche Signaloszillation durch positive Rückkopplung im Echogenerator. Hier laufen die Aktionspotentiale ständig auf den Axonen, die eine geschlossene Kreislinie bilden, im Kreise herum.
Skizze 4: limbische Dauerschwingung ohne Pausen

Spätestens mit der Entstehung des rückgekoppelten Echogenerators war der inzwischen bevorzugte Riesenwuchs hinderlich. Das olfaktorische Gedächtnis wurde unabhängig von der Körpergröße - übrigens auch bei den einst riesigen Insekten, die nun (nach und nach) auch extrem klein werden konnten. Das System mit rückgekoppeltem Echogenerator benötigte keine extrem langen Verzögerungsleitungen. So konnten also auch Tiere mit Zwergwuchs ein gutes olfaktorisches Gedächtnis entwickeln. Dieser Zwergwuchs sollte sich Millionen Jahre später bei den säugetierähnlichen als äußerst nützlich erweisen in einer Zeit, da die Erde von einem gewaltigen Kometeneinschlag verwüstet, die Atmosphäre durch Staub verdunkelt, der Pflanzenwuchs dadurch extrem vermindert und die Nahrung somit knapp wurde. Riesenwüchsige tierische Lebewesen wie etwa die Saurier fielen dieser Katastrophe zum Opfer und starben aus. Nicht so die kleineren Arten mit rückgekoppeltem Echogenerator.
Also wurde zuerst das eine Aktionspotential der olfaktorischen Sensoren in eine Folge von anfangs beispielhaft vierzig Aktionspotentialen verwandelt, weil die Verzögerungsleitung mit Hilfe von Echoneuronen vierzig Mal angezapft wurde. Anschließend wurden alle diese Echoleitungen auf einem Integrationsneuron zusammengeschaltet, wo die vierzig zeitversetzten Aktionspotentiale sich zeitversetzt trafen. Dies führte zu einer durchaus gewünschten Frequenzvervielfachung, wodurch das System empfindlicher reagierte. Dann wurden diese vervielfachten Signale als eigenerzeugter Input wieder zu den Körnerzellen zurückgeschickt. Diese Aufgabe übernahm ein Rücksendeneuron. Dazu mussten die Verzögerungsleitungen, die Echoleitungen für die Einzelechos, die Outputleitung für das sekundäre Echo des Integrationsneurons und die Rückleitung des Rücksendeneurons nur eine Art Kreislinie bilden, deren Ende den Anfang kontaktierte. Viele Millionen Jahre später bezeichneten Neurologen eine ähnliche Konstruktion im limbischen System als den Kreis von Papez. Die neurologische Struktur aus Körnerzellen, Verzögerungsleitungen, Echoneuronen und Integrationsneuronen wurde später von Neurologen als der Hippocampus bezeichnet.
Das Rücksendeneuron konnte seine Aktionspotentiale nun an zwei mögliche Stellen senden: entweder an den Hippocampus oder auch zurück an den olfaktorischen Cortex. Die Natur entschied sich dafür, zur Sicherheit beide Lösungen zu verwenden. Daher erhält sowohl der olfaktorische Cortex als auch das Subiculum des Hippocampus den Output des Rücksendeneurons, um den Schwingkreis an zwei Stellen zu schließen.
Das Rücksendeneuron zu jeder Verzögerungsleitung konnte den Output zusätzlich an andere Subsysteme des Gehirns weiterleiten, z. B. an die Muskulatur zwecks Beuteverfolgung, an Aktivierungssysteme für Blutdruck und andere Parameter, die den Beutefang förderten. Die Rücksendeneuronen bildeten daher im Verlaufe der Evolution einen eigenen neuronalen Kern, dessen Output der Steuerung von wichtigen Körperfunktionen - insbesondere der Aktivierung des Körpers für die Beuteverfolgung, den Kampf oder die Flucht - diente. Denn Gerüche verrieten nicht nur Beute, sondern auch gefährliche Fressfeinde. Wir bezeichnen diesen Kern heute als die Amygdala. Diese laterale Amygdala erhielt später einige wichtige Nebenkerne, die heute auch zur Amygdala zählen, aber andere Aufgaben haben. Der Teil der Amygdala, der ausschließlich die olfaktorischen Signale weiterleitet, wird heute als cortikaler Kern der Amygdala bezeichnet. Als viele andere Signale den Weg zum Hippocampus fanden, die nicht zum olfaktorischen System gehörten, bildeten deren Rücksendeneuronen die laterale Amygdala. Ihre Entstehung ist ein Beweis für den Zugang nichtolfaktorischer Signale ins limbische System. Pitkänen, aber auch Aggleton und Saunders, unterscheiden wie viele andere etwa 10 Substrukturen der Amygdala mit folgenden englischen Benennungen: anterior amygdaloid area, accessory basal nucleus, central nucleus, cortical nucleus (anterior and posterior parts), basal nucleus (magnocellular and parvicellular parts), lateral nucleus, periamygdaloid cortex, paralaminar part of basal nucleus. Im Teil 4 dieser Mongrafie wird sich zeigen, dass die ursprüngliche Aufgabe der Amygdala, die hippocampalen Signale zum Zwecke der Rückkopplung zum Hippocampus bzw. zum Cortex zurückzusenden, von der Evolution völlig in den Hintergrund gedrängt wurde, weil eine neue Aufgabe wesentlich dringender war: Die Digitalisierung des analogen Output der Cortexschichten. Für die reine Signalrückführung hätte die laterale Amygdala völlig ausgereicht.
Die laterale Amygdala, ursprünglich ein Kern mit den Rücksendeneuronen, welche die Hippocampussignale zum Zweck der Rückkopplung zum Hippocampus zurückzusenden hatte, kontaktierte später nicht nur das sympathische und parasympathische Nervensystem zur Steuerung der Körperaktivität, sondern auch den Hypothalamus, weiterhin das zentrale Höhlengrau zur Schmerzunterdrückung bei Kampf oder Flucht, ebenso auch den Locus coeruleus und das Tegmentum zur Steuerung der Wachheit sowie die Retikularfomation. Die Ursache ist systemtheoretischer Natur.
Miteinander gekoppelte Neuronen bilden eine Kette, in der das Inputsignal weitergereicht wird. Wir könnten eine solche Kette von Neuronen als signalgekoppelte Neuronen bezeichnen. Ihre Axone und Dendriten bilden gewissermaßen eine Datenleitung, auf der das gleiche Signal weitergeleitet wird. So kommt beispielsweise ein Signal von einem Neuron des olfaktorischen Cortex zu der zugehörigen Körnerzelle des Hippocampus, von deren Moosfaseraxon zu den angeschlossenen Echoneuronen, von diesen zum zugeordneten Integrationsneuron, dann zum entsprechenden Rücksendeneuron der Amygdala usw. Wenn man davon ausgeht, dass die so verketteten Neuronen nicht nur neuronale Signale austauschen - die ja durch chemische Substanzen, die Transmittermoleküle - repräsentiert werden, so ist auch der Austausch anderer Stoffe denkbar und bereits nachgewiesen. Insbesondere können Markersubstanzen innerhalb einer solchen Signalkette weitergegeben werden. Und wenn diese Markersubstanzen Ortsmarker für die vorgesehenen Zielstrukturen sind, besitzen alle Neuronen der Kette diese Zielmarker, die ihre Axonkollateralen speziell zu den Zielorten wachsen lassen, die durch die Ortsmarker vorgegeben sind. Die Neuronen einer solchen Signalkette sind gewissermaßen markerverwandt. Daher ist es auch verständlich, wenn sie alle samt die gleichen Zielstrukturen mit ihrem Output versorgen.
Dann wäre erklärbar, warum sowohl Septumneuronen z. B. den Hypothalamus kontaktieren, aber ebenso auch Amygdalaneuronen bzw. Hippocampusneuronen oder gar die Ursprungsneuronen des olfaktorischen Cortex. Alle diese signalgekoppelten Neuronen bilden Tupel von markerverwandten Neuronen. Und sie haben dann auch die gleichen Zielgebiete. Diese Strategie umgeht Probleme, die beim Ausfall eines Neurons in der Kette auftreten. Die Zielgebiete erhalten dann einfach den alternativen Input über die übrigen, markerverwandten Neuronen. Daher projizieren sowohl der olfaktorische Cortex als auch das Septum, die Amygdala oder der Hippocampus teils in völlig gleiche Zielstrukturen.
Auch die bereits erwähnte Habenula erhält Input von Septum, von der Amygdala, aber auch von der Area olfactorius sowie von der Regio praeoptica, die ihrerseits ebenfalls Signale untereinander austauschen. Dadurch tritt eine erhöhte Ausfallsicherheit auf, die zur ungeahnten Robustheit neuronaler Systeme führt.
Andererseits haben Neurologen genau aus diesen Gründen das Problem, vernünftig erklären zu müssen, warum fast jedes neuronale Gebiet mit fast jedem neuronalen Gebiet verknüpft ist, wobei der systemtheoretische Zusammenhang von der Natur teils völlig verschleiert wird.
Hingewiesen werden muss darauf, dass jedes einzelne Outputneuron des olfaktorischen Cortex eine eigene Moosfaser im Hippocampus besitzt, zu der eigene Echoneuronen, eigene Schaffer-Kollateralen, ein eigenes Integrationsneuron und ein eigenes Rücksendeneuron in der Amygdala gehören. Und da die Outputneuronen des olfaktorischen Cortex die verschiedenen Geruchsklassen repräsentieren, war für jede dieser Geruchsklassen ein eigener hippocampaler Schwingkreis vorhanden, in dem die Signale rotierten und so vor dem Vergessen bewahrt wurden.
Ebenfalls erwähnt werden sollte der Vollständigkeit halber auch, dass es damals im olfaktorischen Cortex bereits eine Nachbarhemmung gab. Es erwies sich als zweckmäßig, wenn jedes Outputneuron im olfaktorischen Cortex mit den Outputneuronen seiner näheren Umgebung über Interneuronen hemmend verbunden war. So konnten die stärkeren Geruchssignale die schwächeren unterdrücken, wichtige Signale wurden also wirksamer, unwichtige dagegen geschwächt. Bereits bei den Insekten gibt es diese rezeptive Nachbarhemmung im olfaktorischen System. Diese rezeptive Nachbarhemmung wurde in vielen anderen Neuronenkernen des Gehirnsystems beibehalten und erhöhte den Kontrast in den Outputsignalen.
Im Prinzip erzeugt der oben beschriebene Ur-Hippocampus zu jedem einzelnen Inputsignal, genauer gesagt zu jedem erregten cortikalen Outputneuron ein höherfrequentes Dauersignal, dessen Aufgabe es war, auch noch später an die vorbeischwimmende Beute zu erinnern und die zu ihrer Verfolgung nötigen Körperbewegungen zu veranlassen. Ebenso wurde ein Feindsignal durch Signaloszillation am Vergessen gehindert, so dass die zur Flucht oder zum Angriff erforderlichen Aktionspotentiale für nötige Reaktionen für hinreichend lange Zeit garantiert waren. Quasi eine Schaltung für ein Zeitgedächtnis. Ein einmal angestoßenes Inputsignal rotierte in der limbischen Schleife dauerhaft hin und her und bewahrte so die Erinnerung an die Beute. Deren Verfolgung wurde infolge des "Nichtvergessens" möglich, ebenso eine nötige Flucht oder eine Verteidigung. Die dafür erforderlichen Aktionspotentiale wurden von den dauerhaft rotierenden Signalen geliefert.
Wenn aber jedes Input-Aktionspotential der olfaktorischen Rezeptoren auf der Moosleitung beispielsweise vierzig neue Aktionspotentiale erzeugte, die wiederum zur Körnerzelle an den Moosfaseranfang zurückgesendet und wiederum vervierzigfacht wurden, um wieder zum Herkunftsort zurückzukehren und erneut vervierzigfacht zu werden usw., warum entstand dann nicht eine superhochfrequente Schwingung von fast unendlicher Frequenz durch die fortwährende Vervierzigfachung?
Hier kam die Refraktärzeit der Neuronen ins Spiel, die bereits damals unverzichtbar war. Nach jedem einzelnen Aktionspotential machte jede Nervenzelle eine extrem kurze Pause von etwa einer Millisekunde. Diese Pause nennen wir Refraktärzeit. In der Refraktärzeit kann das Neuron auch bei stärkster Erregungszufuhr kein Aktionspotential bilden. Daher gab es eine obere Grenze für die Feuerrate. Kein Neuron konnte schneller feuern, als es der Kehrwert der Refraktärzeit vorgab. Die Natur verhinderte damit in positiv rückgekoppelten Signalschleifen einen zerstörerischen Anstieg der Resonanzfrequenz. So konnte der Vorteil einer positiven Signalrückkopplung zur Erzeugung einer stabilen Dauerschwingung genutzt werden, ohne das System total zu überlasten.
Da durch die Refraktärzeit die maximale Feuerrate von Neuronen nach oben begrenzt war und in etwa den Bereich von 0 bis 1000 Hz, also etwa drei Zehnerpotenzen umfasste, gab es ein weiteres Problem. Die Signalstärken schwankten in der Natur nicht nur im Bereich von 0 bis 1000, sondern in viel größeren Intervallen. Daher konnten die Rezeptoren die Signalstärke nicht linear in eine Feuerrate umsetzen. Es blieb nur eine mögliche Variante als technische Lösung übrig: die logarithmische Abbildung der natürlichen Signalstärke in eine Feuerrate. Deshalb haben die meisten Rezeptoren eine logarithmische Kennlinie. So bleiben die Feuerraten in dem Bereich, der durch die Refraktärzeit vorgegeben ist. Nur spezielle Neuronen sind in der Lage, Feuerraten von etwa 5000 Hz zu erreichen. Meist bleiben die Feuerraten deutlich unter 1000 Hz.
Diese maximale Feuerrate wurde nunmehr auch im rückgekoppelten Echogenerator erreicht, wenn der Output der Integrationsneuronen wieder als Input zu den Körnerzellen zurückgeleitet wurde. Aber diese neurologische Lösung hatte zwei entscheidende Konstruktionsfehler: Erstens führte sie zur erhöhten Belastung der beteiligten Neuronen, die nunmehr, einmal aktiviert, unablässig Aktionspotentiale erzeugen müssen. Im Schwingkreis existierte eine höherfrequente, also tetanische Dauerschwingung, die Neuronen feuerten ununterbrochen. Denn jeder Output des Hippocampus wurde dem Hippocampus wieder als Input zugeführt. So feuerten die Neuronen mit maximaler Feuerrate. Dies führte auf die Dauer zur Überlastung und zum vorzeitigen Absterben der Neuronen, so dass diese ständig neu gebildet werden mussten. Die Fähigkeit zur Neubildung von Neuronen, aber auch Rezeptoren ist noch heute im limbischen System nachweisbar.
Der zweite Nachteil war viel schlimmer: Infolge der Rotation der Signale im elementaren "Papez-Kreis" war das Signal noch nach Minuten, ja gar nach Stunden oder Tagen vorhanden. Selbst wenn die Beute entwischt und bereits über alle Berge war oder günstiger Weise schon verspeist oder sogar verdaut worden war. Diese ewige Signalrotation galt es zu verhindern. Denn nach dem Verspeisen oder dem Verschwinden der Beute erzeugte sie im System die Illusion, sie wäre noch vorhanden.
Gewiss war es angebracht, ein Beutetier, welches sich schnell versteckt hatte, noch eine ganze Weile zu suchen. Wenn jedoch das genaue Durchforsten der näheren Umgebung nicht zur Beute führte, war diese wahrscheinlich entflohen und weit entfernt. Dennoch würden die dauerhaft rotierenden Aktionspotentiale ihres olfaktorischen "Fingerabdrucks" die Illusion erzeugen, sie wäre noch in unmittelbarer Nähe.
Eine Illusion, also eine "geistige Vorstellung" ist zwar prinzipiell etwas positives, vielleicht sogar der Beginn von Bewusstsein und Intelligenz bereits in grauer Urzeit. Aber bei der Beutesuche ist eine Illusion hinderlich, da sie keiner realen Beute entspricht.
Die Evolution erforderte eine technische Lösung beider Probleme, die hier als Hippocampusproblem 1 und 2 bezeichnet werden mögen:
Hippocampusproblem Nr. 1:
Die Dauerrotation der Inputsignale musste auf irgendeine Weise von kürzeren oder längeren Pausen unterbrochen werden, in denen sich die feuernden Neuronen erholen konnten, wodurch ihre Lebensdauer beträchtlich zunahm.
Hippocampusproblem Nr. 2:
Die Dauerrotation der Inputsignale musste nach einer gewissen Zeit von allein zum Stillstand kommen, wenn die Intensität der auslösenden "Duftstoffe" abnahm, oder weil die Beute verspeist worden war, entfliehen konnte oder weil neue Beute mit einem anderen "Beuteduft" auftauchte. Auch das Auftauchen von Fressfeinden mit charakteristischem "Feindduft" musste die Erinnerung an die Beute löschen und eine sinnvolle Fluchtreaktion, eine Verteidigung oder gar eine Angriff ermöglichen.
Eine erste Hilfslösung bestand darin, dass ständig feuernde Neuronen gegen weiteren, erregenden Input mit der Zeit unempfindlicher werden. Die erstmalige Erregung inaktiver Neuronen ergibt oft eine höhere Feuerrate als die spätere, die Erregungsempfindlichkeit kann also mit der Zeit abnehmen. Derartige Erregungskennlinien sind noch heute zu finden, besonders bei vielen Rezeptoren des Nervensystems. Diese Lösung war jedoch bei Weitem nicht ausreichend.
Die Lösung zum Hippocampusproblem Nr. 1 übernahm eine neurologische Struktur, die wir heute als Septum bezeichnen. Offenbar existierten die Septumkerne bereits lange vor der Ausbildung des Hippocampus. Die Septumkerne produzieren den Transmitter Acetylcholin, der schon in grauer Vorzeit der Aktivierung der Muskeln, aber auch der vorhandenen neurologischen Strukturen diente. Noch heute hat das cholinerge Aktivierungssystem eine wichtige Funktion im Gehirn, auch wenn es wohl nicht mehr die Motoneuronen der Muskeln direkt ansteuert. Es war also angebracht, den Output des Hippocampus, der ja durch eine Beute verursacht worden war, zur Aktivierung des cholinergen Systems zu nutzen. Daher projizierte der Hippocampus erregend ins Septum und verschaffte dem Lebewesen dadurch eine schnelle Systemaktivierung beim Auftauchen von Beute oder Gefahr.
Es mag Zufall gewesen sein, dass cholinerge Septumaxone auch den Weg zurück in den Hippocampus fanden. Eine Erregung der hippocampalen Outputneuronen war jedoch wenig nutzbringen, denn diese waren bereits erregt. Daher probierte die Evolution einen alternativen Ansatz. Cholinerge Septumaxone erregten die zahlreich vorhandenen GABAergen Interneuronen des Hippocampus. Kaum ein Neuronenkern ist frei von hemmenden Interneuronen, deren Hauptaufgabe die Kontrastverstärkung zwischen den Outputsignalen ist. Daher konnte der erregende, cholinerge septale Output die GABAergen Interneuronen des Hippocampus erreichen, denn das Hauptziel von Neuronen ist die gegenseitige kontaktaufnahme.
Ebenso bot es sich an, einige GABAerge Interneuronen des Septums, die damals wie heute der rezeptiven Nachbarhemmung und daher der Kontrastverstärkung im Septum dienten, mit der Fähigkeit zur Bildung längerer Axone auszustatten. Dann konnten die aus ihnen gebildeten GABAergen Projektionsneuronen des Septums ihrerseits die glutamatergen Projektionsneuronen des Hippocampus hemmen.
Die Hemmung von Outputneuronen eines Kerns oder Gebietes durch hemmende Projektion auf die Outputneuronen wollen wir in dieser Monografie als direkte Hemmung bezeichnen. Sie setzt direkt am Ursprungsort des Signals an, also direkt bei dem Neuron, dessen Output unterdrückt werden soll.
Wenn es eine direkte Hemmung gibt, so sollte es auch eine indirekte Hemmung geben. Unter einer indirekten Hemmung wollen wir die Erregung der hemmenden Interneuronen verstehen, die sich in der Nähe des betreffenden Outputneurons befinden. Wie bereits postuliert, existieren in fast jedem neuronalen Kern hemmende, meist GABAerge Interneuronen, deren Hauptaufgabe darin besteht, schwächere Signale zu hemmen, damit die stärkeren Signale sich durchsetzen. Sie dienen also der rezeptiven Nachbarhemmung.
Wenn nun Projektionsneuronen anderer Kerne genau diese hemmenden Interneuronen erregen, so wird im Endresultat eine ganze Gruppe von benachbarten Outputneuronen gehemmt. Diese Art der Hemmung bezeichnen wir als indirekte Hemmung. Sie erlaubt die Verwendung erregender Projektionssignale, die erst dadurch hemmend wirken, indem sie indirekt die hemmenden Interneuronen erregen, die wiederum die beabsichtigte Signalhemmung bewirken. Dabei ist es auch denkbar, dass diese Interneuronen eine eigene Klasse bilden, die dann nicht mehr direkt der rezeptiven Nachbarhemmung dient, sondern nur noch eine Umschaltung des ursprünglich erregenden Transmitters auf einen hemmenden bewirkt.
Bei der Beschreibung cytoarchitektonischer Strukturen und deren Verknüpfungen gilt es also genau zu analysieren, ob ein Input in ein Gebiet oder einen Kern dessen outputliefernde Projektionsneuronen hemmt oder dessen hemmmende Interneuronen erregt. Im ersten Fall liegt eine direkte Hemmung vor, im zweiten Fall eine indirekte. Durch die Verwendung dieser Begriffe kann die sonst umständliche Beschreibung der Hemmungswirkung textlich deutlich abgekürzt werden. Da als dritte Variante die Erregung der Projektionsneuronen möglich ist und viertens auch die Hemmung der hemmenden Interneuronen möglich wäre, gibt es also wenigstens vier Versionen neuronaler kontakte. Daher ist die Angabe der verwendeten Transmitter und der Typ der kontaktierten Neuronen für die Aufklärung einer neuronalen Schaltung so wichtig.
Während also der Hippocampus das Septum erregt, wirkt das Septum hemmend auf den Hippocampus und benutzt gleich zwei Arten der Hemmung: die direkte Hemmung über GABAerge Projektionsneuronen und die indirekte Hemmung über die Erregung der hemmenden Interneuronen.
Die Septumkerne und der Hippocampus bilden dadurch bereits in früher Evolutionsgeschichte eine eng zusammenarbeitende Einheit. Warum aber konnten die Septumkerne die höherfrequente Dauerschwingung des Hippocampus durch Pausenbildung unterbrechen? Wie war dies möglich?
Einer weit verbreiteten Theorie zufolge befanden sich beim Urhirn, welches noch stark an das sogenannte Neuralrohr erinnerte, der Hippocampus und das Septum genau an diametral entgegengesetzten Stellen des Neuralrohres. Dadurch erreichten beide (zufällig) den maximalen Abstand voneinander. Die erregenden, glutamatergen Signale vom Hippocampus mussten also eine längere Wegstrecke zurücklegen, bis sie im Septum ankamen. Wenn sie dort auf den hemmenden Transmitter GABA umgeschaltet wurden und topologisch geordnet wieder zum Hippocampus zogen, war die gleiche Wegstrecke nochmals zurückzulegen.
Nun konnten sich die neuronalen Signale nicht geradlinig durch das Neuralrohr ausbreiten, denn dieses enthielt einen mit Flüssigkeit gefüllten Hohlraum. In heutigen Gehirnen ist dieser Hohlraum - stark formverändert - erhalten geblieben und bildet das flüssigkeitsgefüllte Ventrikelsystem. Noch heute bildet ein Teil des Hippocampuskörpers die räumliche Grenze des flüssigkeitsgefüllten Ventrikelsystems des Gehirns der Wirbeltiere und beweist die Gültigkeit dieser Neuralrohrtheorie. Signale konnten sich also beim Neuralrohr nur entlang der gekrümmten Oberfläche ausbreiten, die auch durch die Nervenzellen gebildet wurde.
Wenn das Neuralrohr einen Radius von etwa 10 Millimetern hatte, die Signale also auf einer Halbkreislinie vom Hippocampus zum Septum gelangten und fast auf der gleichen Halbkreislinie wieder zurück, so war genau der Weg zurückzulegen, der dem Kreisumfang entspricht. Ein Kreis von etwa 10 Millimetern Radius hat aber einen Umfang von etwa 63 Millimetern. Ein Aktionspotential mit einer Geschwindigkeit von 1m/s legte diese Strecke in 63 Millisekunden zurück. Genau nach dieser Zeitspanne erreichte ein Aktionspotential, welches vom Hippocampus zum Septum gesendet wurde, um dort auf GABA umgeschaltet und zurückgesendet zu werden, wieder dem Hippocampus. Auf eine aktive Schwingung von 63 Millisekunden Dauer folgte also immer eine entsprechende GABAerge, also hemmende Schwingung aus dem Septum. Und diese unterdrückte die entsprechenden Hippocampussignale total - genau für die Zeitdauer von 63 Millisekunden.
Aus der ursprünglichen Dauerschwingung wird also durch stark hemmende Rückkopplung mit der Zeitverzögerung von 63 Millisekunden eine getaktete und höherfrequente Dauerschwingung. Auf eine tetanische Erregung von 63 Millisekunden Dauer folgte eine signalfreie Pause von ebenfalls 63 Millisekunden Dauer. Damit hatte die Hüllkurve dieser Schwingung eine Schwingungsdauer von etwa 125 Millisekunden, woraus eine Hüllkurvenfrequenz von etwa 8 Hertz folgt. Die Zahlenangaben sind als Beispielwerte zu betrachten.
Diese getaktete Schwingung von etwa 8 Hz im Hippocampus wird heute als das hippocampale Theta bezeichnet. Sie ermöglichte bereits den Urzeit-Tieren, sich an ein olfaktorisches Signal zu erinnern, obwohl die Beute zu fliehen versuchte, so dass man ihr nachstellen konnte. Im Gegensatz zu einer ununterbrochenen Dauerschwingung werden die beteiligten Neuronen nun nicht mehr überlastet, weil sie andauernd kleine Pausen von etwa 1/16 Sekunde machen, in denen sie z. B. den nötigen Transmitter produzieren oder ihren Stoffwechsel auf Vordermann bringen können.
Skizze 5: Das hippocampale Theta eines aktiven Signals - eine getaktete tetanische Schwingung

Erwähnt werden sollte, dass der Systemtakt in magnocellularen Striosomensystem (zufällig?) etwa die gleiche Grundfrequenz hat. Auch hier wären die gleichen Überlegungen angebracht hinsichtlich der Notwendigkeit, in tetanische Dauerschwingungen geeignete Pausen einzubauen (Siehe Monografie Teil 1 und 2).
Die erregende Projektion des Hippocampus zum Septum und die hemmende vom Septum zurück zum Hippocampus schafft im Zusammenspiel mit der Zeitverzögerung durch die größere Axonlänge die Lösung für das Hippocampusproblem Nr. 1.
Nun pflegt die Natur sich oftmals abzusichern. Falls die direkte GABAerge Projektion vom Septum zum Hippocampus zeitweilig oder dauerhaft ausfallen sollte, könnte alternativ auch eine erregende Projektion vom Septum zum Hippocampus diese Aufgabe übernehmen. Cholinerge Projektionsneurone des Septums könnten dann die zahlreich vorhandenen, GABAergen Interneuronen des Hippocampus erregen, die ihrerseits im Aktivitätsfalle die glutamatergen Pyramidenzellen im Hippocampus hemmen. Diese indirekte Variante der Hippocampushemmung wird neben der bereits beschriebenen im Säugerhirn tatsächlich genutzt.
Skizze 6: Zusätzliche negative Rückkopplung vom Septum zum Hippocampus zur Pausenbildung
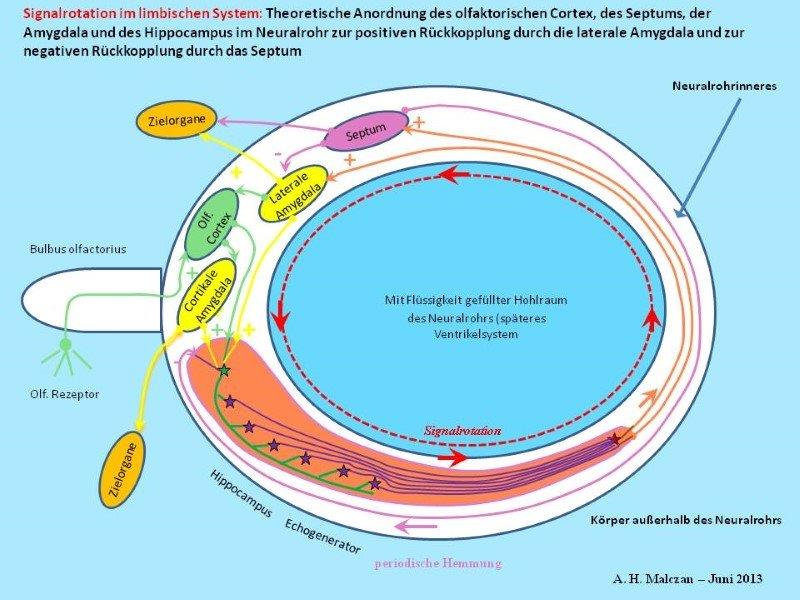
Die Absicherung der sinnvollen Arbeitsweise einer neuronalen Schaltung durch mehrere Varianten bewirkt eine Verkomplizierung der Erkennung wesentlicher Zusammenhänge. Zur Sicherstellung der periodischen Schwingungsunterbrechung gibt es die direkte und die indirekte Hemmung des Hippocampus durch das Septum. Andererseits wurden auch analog GABAerge Projektionen des Septums in die Amygdala beobachtet. Diese können - falls die Hemmung des Hippocampus zeitweilig gestört sein sollte - die gleiche Wirkung haben: die Unterbrechung der ständigen Signaloszillation durch kurze Pausen. Ebenso könnte die erregende Projektion vom Hippocampus zum Septum zur Sicherheit durch eine gleichartige, glutamaterge Projektion von der Amygdala zum Septum ergänzt werden. Doch genau diese wird in der Realität nicht beobachtet. Dies liegt daran, dass die Amygdala und das Septum zu eng benachbart sind. Signale der Amygdala würden das Septum sofort erreichen. Einer Erregung der Amygdala durch das Septum würde unmittelbar fast ohne Zeitverzögerung eine Hemmung der Amygdala folgen. was die Entstehung der gewünschten tetanischen Erregung sehr stören würde. Daher gibt es nur die hemmende Einwirkung des Septums auf die Amygdala.
Das gleiche Ziel, positive und negative Rückkopplung im limbischen Schwingkreis kann also zur Sicherheit an mehreren Stellen realisiert werden.
In Schwingkreisen können unterschiedlichste Phänomene beobachtet werden. Ein interessantes Resultat von neuronalen Schwingkreisen mit starker Frequenzvervielfachung und positiver und negativer Rückkopplung besteht in der Normierung der Signale. Durch die starke Frequenzvervielfachung auf Grund der hohen Anzahl der Echoneuronen zu einer Moosfaser entsteht eine tetanische Schwingung, deren fast konstante Feuerrate nur noch durch die Refraktärzeit vorgegeben wird. Da die Integrationsneuronen dieser Subsysteme alle etwa die gleichen Parameter haben, haben sie auch alle etwa die gleiche Refraktärzeit. Dadurch entsteht im Falle der Aktivität der zugehörigen Signale in jeder Signalschleife etwa die gleiche Frequenz der tetanischen Schwingung. Andererseits wird durch die negative Rückkopplung diese tetanische Schwingung durch Pausen unterbrochen. Und da die Zeitverzögerungen der Aktionspotentiale vom Hippocampus zum Septum und zurück für alle Einzelschwingkreise etwa die gleiche ist, ist auch die Pausendauer durch die septale Hemmung in etwa gleich groß. Also sind sowohl die Frequenz der tetanischen Schwingung als auch die Pausendauer normiert. Zusätzlich sind die verschiedenen Schwingungen nicht nur normiert, sondern auch lose gekoppelt, also teilweise synchronisiert. Dafür sorgt die rezeptive Nachbarhemmung über die zahlreichen hemmenden Interneuronen.
Diese Normierung wirft viele klassische Vorstellungen über den Haufen. Normalerweise stellen wir uns vor, die Feuerrate zu einem Signal würde mit wachsender Signalintensität zunehmen. Im den limbischen Schwingkreisen trifft genau dies nicht mehr zu. Ein schwaches olfaktorisches Signal mit einer geringen Feuerrate erleidet während des Durchlaufens der Moosfaser eine Frequenzanhebung bis zur Maximalfrequenz, die nur von der Refraktärzeit abhängt. Zwischen schwachen, mittelstarken und starken olfaktorischen Signalen gibt es bei gut ausgebildetem Hippocampus frequenzmäßig kaum Unterschiede! Alle werden auf Maximalfrequenz angehoben und lediglich auf Grund der negativen Rückkopplung von Pausen unterbrochen, deren Pausenlänge ebenfalls normiert ist.
Daher musste die Natur Wege und Mittel suchen, die unterschiedliche Stärke von olfaktorischen und anderen limbischen Signalen anders zu codieren. Genau deshalb erfand das limbische System die Digitalisierung der Signale. Dann konnten verschieden starke Signale des gleichen Geruchs auf unterschiedlichen Binärleitungen aktiv werden, weil jede Signalstärke eine andere Signalleitung benutzte. Und alle aktiven Signale konnten die gleiche Feuerrate benutzen und waren daher innerhalb des Systems normiert. Diese Normierung der Signale finden wir bei Computern wieder. Nicht die untereinander identischen Bitsignale, sondern nur die Leitungsadresse bestimmt, welche Bedeutung ein normiertes Bit besitzt. Eine Signalstärke gibt es bei Digitalcomputern ebenfalls nicht, sondern nur aktive und inaktive Leitungen. Im Teil 4 dieser Monografie - als eigenständiges Werk verlegt - wird gezeigt werden, dass mit der Herausbildung der hemmenden Interneuronen in Neuronenkernen der wesentliche Grundstein für die Digitalisierung gelegt worden ist.
Die GABAergen Interneuronen des Hippocampus dienen auch der Lösung des Hippocampusproblems Nr. 2. War die Beute bereits verspeist worden, so begann deren Verdauung im Magen. Die erhöhte Aktivität im Magen war jedoch nicht nur chemischer Art. Die Rezeptoren im Verdauungssystem wirkten als Messfühler und konnten die höhere chemische Aktivität in eine neuronale Aktivität umwandeln.
Wenn nun geeignete Rezeptoren des Verdauungssystems während der Verdauung stärkere erregende Signale zu den GABAergen Interneuronen des Hippocampus sendeten, wurde das hippocampale Theta der olfaktorischen Signale gehemmt. Die zugehörigen Schwingungen kamen zum Erliegen. Die Aktivität im Verdauungssystem wirkte hemmend auf den Hippocampus und löschte dort die in den Schleifen rotierenden Signalaktivitäten, die von den olfaktorischen Rezeptoren angestoßen worden war. Das satte Tier vergaß die Beute und wurde träge. Dies trifft sogar noch heute zu!
Später konnten auch andere starke Signale des "Gehirnsystems" den Weg zu den hemmenden Interneuronen des Hippocampus finden, so dass ein ununterbrochenes hippocampales Theta nicht mehr "ewig" anhielt, sondern nach Minuten oder maximal nach Viertelstunden oder Stunden wegen der GABAergen Dämpfung zum Stillstand kam.
Ein weiterer Aspekt der GABAergen Hemmung durch die Interneuronen besteht darin, dass jedes hemmende Interneuron eine größere Anzahl von hippocampalen Körnerzellen erreicht. Dadurch werden auch viele benachbarte Moosfasern synchron gehemmt, so dass eine Synchronität des Schwingens der Hippocampusneuronen bewirkt wird. Erst dadurch ist das hippocampale Theta überhaupt messtechnisch auffällig geworden. Je mehr Neuronen im Hippocampus synchron feuern, umso besser lassen sich diese Theta-Wellen z. B. im EEG an der Kopfhaut nachweisen. Eine Analogie gibt es im magnocellularen Striosomensystem, wo die vielen Systemschwingungen der Elementarschwingkreise durch dendrodendritische Kopplung der dopaminergen Neuronen in der Substantia nigra pars compacta (lose) synchronisiert werden (Siehe Teil 1 und 2 dieser Monografie).
Die Unterbrechung der Signaloszillation im Hippocampus nach erfolgreichem Beutefang, bei erfolgreicher Flucht der Beute oder durch neue Signale bei Feindkontakt war durch eine externe Erregung der GABAergen Interneuronen im Hippocampus möglich geworden.
Aber das System aus Hippocampus, Septum und Amygdala hatte inzwischen drei Eintrittspunkte für einen möglichen Input. Die Unterbrechung der Oszillation einer ganz bestimmten Signalgruppe konnte auf zwei weitere Arten erfolgen. Anstelle der Erregung der GABAergen Interneuronen im Hippocampus konnte auch das zugehörige glutamaterge Rücksendeneuron in der lateralen Amygdala gehemmt werden. Diese Hemmung musste jedoch zeitlich so lange andauern, wie die Umlaufzeit der Signale betrug, damit alle Einzelechos komplett gelöscht wurden. Die Neuronen, die diese Hemmung bewirkten, bildeten im Verlaufe der Evolution einen eigenen Neuronenkern, der heute auch zur Amygdala gezählt wird. Es ist der zentrale Kern der Amygdala, der hemmend in die laterale Amygdala projiziert, um die Signaloszillation der zugehörigen Signale dauerhaft zu unterbrechen. Erkennungsmerkmal der zentralen Amygdala sind die GABAergen Neuronen, die hemmend zu den anderen Nachbarkernen der Amygdala projizieren. Im Teil 4 dieser Monografie wird sich zeigen, dass diese Neuronen später eine viel wichtigere Aufgabe übernehmen konnten, die den Wirbeltieren einen ungeheuren Intelligenzschub bescherte: die digitale Verarbeitung von Signalen und die Entstehung von Lernfähigkeit. Doch dies soll nicht hier behandelt werden, da es hier nur um die Signalverarbeitung innerhalb des limbischen Systems geht. Die zentrale Amygdala konnte jedenfalls erregende Signale, die sie erhielt, in den hemmende Transmitter überführen und so Stoppsignale zur lateralen Amygdala senden.
Ebenso konnte bezüglich eines bestimmten Signals dasjenige zugehörige GABAerge Projektionsneuron im Septum stark und länger andauernd erregt werden, welches die zusammengefassten Echosignale vom Integrationsneuron erhielt, um sie als GABAerges Hemmungssignal zu den Pyramidenzellen zu senden und deren Aktivität zu unterbinden. Die langdauernde Erregung des GABAergen Septumneurons führte zu einer landdauernden GABAergen Hemmung der zugehörigen Hippocampusneuronen und zur Unterbrechung der Signalrotation dieses Signals.
Und drittens gab es den alternativen septalen Weg, der schon angedeutet wurde. Im Hippocampus gibt es jede Menge hemmender Interneurone, die den Transmitter GABA verwenden. Ihre Aufgabe ist die rezeptive Nachbarhemmung, die zu einer Kontrastverstärkung des Outputs führt und schwächere Signale eliminiert. Cholinerge Projektionsneuronen des Septums könnten daher (wie bereits beschrieben) im Hippocampus die GABAergen Interneuronen länger andauernd erregen. Dies würde ebenfalls zur Hemmung der Signaloszillation führten. Wenn also die cholinergen Septumneuronen längere Zeit von außen dauererregt würden, so bräche die zugehörige Signaloszillation im Hippocampus zusammen.
Entweder GABAerge Projektionen in den Hippacampus oder die laterale Amygdala konnte die Signalrotation durch direkte Hemmung zum Erliegen bringen, oder eine Erregung der GABAergen Interneuronen des Hippocampus oder der lateralen Amygdala war in der Lage, die Signalrotation entsprechender Signale zu beenden. Die Erregung entsprechender Neuronen der zentralen Amygdala bewirkte den gleichen Effekt.
Falls aber die Beute entfliehen konnte, war ihre Verdauung unmöglich geworden. In diesem Falle fehlten die Signale der Verdauungsorgane, die z. B. die Interneuronen des Hippocampus oder der Amygdala erregten, so dass die Oszillation der Beutesignale unterbrochen werden konnte. Hier erwies es sich als zwingend notwendig, über innere Taktgeber zu verfügen, die nach einer gewissen Zeit - der maximalen Beuteverfolgungsdauer - für eine Unterbrechung der Signaloszillation sorgten. Es war anfangs sicherlich kein circadianer 24-Stunden-Rhytmus aus dem Nucleus suprachiasmaticus, aber es gab mit Sicherheit einen Neuronenkern, dessen neuronale Aktivität beispielsweise im Zwei-Stunden-Rhythmus schwankte. Wenn in diesem Beispiel die Aktivität der Neuronen dieses Kerns alle zwei Stunden ein Maximum erreichte, konnte deren Aktionspotentiale die GABAergen Interneuronen des Hippocampus erreichen und dort alle rotierenden Signale löschen. Alternativ konnten die GABAergen Projektionsneuronen des Septums länger andauernd erregt werden, die ihrerseits hemmend zu den Pyramidenzellen des Hippocampus projizierten. Der Taktgeber konnte aber auch über die direkte oder indirekte Hemmung der Amygdala für die Unterbrechung der Signalrotation sorgen. Wer nicht über einen solchen Taktgeber verfügte, vergeudete Zeit und Energie. Er verfolgte tagelang, wochenlang oder gar sein ganzes Leben lang eine Beute, deren Beuteduft ihn vor Tagen, Wochen oder Jahren erstmalig erregt hatte. Die in seinem Hippocampus rotierenden Beutesignale waren also eine fortwährende Illusion. Während er durch die völlig sinnlose Verfolgung dieser Illusion zunehmend Energie vergeudete, konnte er schon bald dem Hungertode anheimfallen, wenn nicht zufällig eine andere Beute mit stärkerem Beuteduft auftauchte. Wer aber periodisch, z. B. alle zwei Stunden, seine limbischen Rotationssignale einfach löschte, konnte still und energiesparend vor sich hinwarten, bis eine neue, fette Beute mit ihrem Duft die Signaloszillation neu startete, die Körperaktivierung in Gang setzte und Verfolgung und Kampf einleitete.
Die periodische Löschung der rotierenden limbischen Signale im Papez-Kreis erfolgt auch heute noch durch Zeitrhythmen, deren Periode von wenigen Stunden bis zu einem 24-Stunden-Rhytmus reichen kann. Die Verhinderung der periodischen Signallöschung z. B. durch Schlafentzug führt bei Lebewesen zu gravierenden Problemen.
Überhaupt erforderte das Leben einen zyklischen Ablauf. Beutefang, Beuteverzehr, Beuteverdauung, Ausruhen wechselten in stetiger Abfolge. Und die reine Existenz des sehr empfindlichen olfaktorischen Sinnes führte zur Notwendigkeit, spezielle Organe zu entwickeln, die solch ein zyklisches Wechselspiel unterstützten. Wer beispielsweise die Reststoffe der Verstoffwechselung der Nahrung kontinuierlich ins Wasser entließ, hinterließ eine markante Duftspur, die genau zu ihm führte. Wer aber geeignete Hohlorgane wie eine Blase oder einen Mastdarm entwickelte, in denen diese Stoffwechselreste zunächst zwischengelagert wurden, konnte dem Geruchssinn seiner Fressfeinde längere Zeit verborgen bleiben, um sein "Geschäft" unbeobachtet in ungefährlicher Umgebung zu erledigen.
Das Arbeitsprinzip des rückgekoppelten Hippocampus förderte gewissermaßen einen zyklischen Lebenswandel. Signale wurden olfaktorisch, aber auch zyklisch durch Taktgeber gestartet, bewirkten länger anhaltende Reaktionen und benötigten anschließend Stoppsignale, um inaktiviert zu werden. Notfalls übernahmen Taktgeber eine periodische Inaktivierung.
Die periodische Löschung der limbischen Signale war auch deshalb nötig, weil jedes dieser Signale während seiner Rotation neue Aktionspotentiale erzeugte und dadurch Reaktionen aktivierte. Traf ein Aktionspotential vom olfaktorischen Cortex in einer Moosfaser ein, so generierten die CA3-Pyramidenzellen durch Anzapfen dieser Moosleitung eine ganze Folge von Aktionspotentialen. Diese erreichten die Amygdala, das Septum und das Corpus mamillare und erregten die zugehörigen Neuronen, die wiederum mit Aktionspotentialen antworteten. Ein bereits oszillierendes Signal konnte also nur durch ein benachbartes, neueres Signal rezeptiv gehemmt werden, weil eine Umlaufermüdung bei älteren Signalen zur relativen Abnahme der Feuerrate führte. Ansonsten gab es nur noch die Möglichkeit der periodischen Löschung durch geeignete Taktgeber. Diese konnten sich durchaus auf ausgewählte Signalgruppen spezialisieren. So wären Taktgeber denkbar, die beispielsweise ausschließlich Signale des Verdauungssystems löschten, damit das Lebewesen wieder neuen Hunger verspürte. Blieb das limbische Sattheitsgefühl ungelöscht, verhungerte man eventuell, obwohl man ein wohliges Sattheitsgefühl verspürte. Die Selbstreizung von Ratten, die eine elektronische Reizung ihrer limbischen Strukturen mittels Tastendruck dem Fressen vorzogen, zeigt die Gefährlichkeit der Nichtlöschung elementarer limbischer Reize.
Andererseits bewirkt ein "Reset" (Computertechnik: "Zurücksetzen") der limbischen Signale z. B. während des Schlafes eine höhere Bereitschaft für die neuen Signale des folgenden Tages. Man erwacht morgens mit "geleertem" Kopf. Wer dies nicht kann, vergeudet Kraft und Energie in die Auswertung imaginärer, weil längst ungültiger Signale.
Sicherlich war es günstig, die in den limbischen Schleifen rotierenden Signale, speziell die bisher unbekannten, also die neuen, vor der Löschung zu erlernen. Daher entwickelten sich Algorithmen, die während spezieller Schlafphasen (REM-Phasen) zur dauerhaften Abspeicherung dieser temporären Signale im Cerebellum führten. Eine wesentliche Voraussetzung war der signaltechnische Zugang limbischer Signale ins Cerebellum. Die andere Voraussetzung war bereits erfüllt: LTP und LTD im Cerebellum waren möglich geworden, weil diese limbischen Signale bereits in Form tetanischer Erregungen vorlagen, die auch durch die nötigen Kontrollpausen unterbrochen wurden. In diesen Pausen prüften die speichernden Purkinjezellen den Erfolg der bisherigen synaptischen Veränderung der Kopplungsstärke bei den Eigen- und Fremdsignaldetektoren (Siehe Teil 1 und 2 dieser Monografie). So wurden die Signale aus dem limbischen Aktivspeicher in den cerebellaren Passivspeicher überführt.
Zusammenfasseng kann gesagt werden, dass die Neuronen, die eine periodische Unterbrechung der Schwingung im sogenannten Theta-Rhythmus bewirkten, ebenso geeignet sind, die Signaloszillation auch endgültig zu beenden. Dazu müssen sie nur so lange erregt werden, bis jedes der rotierenden Aktionspotentiale durch Hemmung gelöscht worden war.
Aber nicht nur die Signale der entflohenen Beute galt es zeitnah zu löschen. War diese Beute nicht entflohen, sondern konnte gefressen werden, so erzeugten die gustatorischen Rezeptoren während des Verspeisens der Beute entsprechende Geschmackssignale. Diese fanden ebenfalls den Weg zum Hippocampus, aber von dort ebenso zum Magen, wo sie z. B. die Erzeugung der nötigen Magensäure für die bevorstehende Verdauung bewirkten. Diese starke Aktivierung des Verdauungssystems, deren zugehörige Aktivierungssignale ja ebenfalls in der limbischen Schleife rotierten, war am Verdauungsende völlig überflüssig und sogar schädlich. Daher mussten geeignete Rezeptoren das mögliche Verdauungsende ermitteln und mit ihren Signalen die Signalrotation der Beutesignale im limbischen System beenden.
Es gab also durchaus viele Gründe dafür, eine einmal angestoßene Signalrotation zu beenden.
Aber auch die Umkehrung war möglich. Es erwies sich als sehr zweckmäßig, auch den externen Start einer Signalrotation zu ermöglichen. Ein inaktives, aber auch ein völlig neues, anderes, möglicherweise auch ein nichtolfaktorisches Signal (z. B. Hungergefühl) aus anderen Bereichen konnte in den Hippocampus eingespeist werden, indem es beispielsweise geeigneten Neuronen der lateralen Amygdala erregend zugeführt wurde. Diese Neuronenklasse war ja bereits existent. Man konnte den erregenden Input an ein speziell dafür erzeugtes Rücksendeneuron der lateralen Amygdala senden, damit dessen Erregung die Signaloszillation dieses speziellen Signals im limbischen Schwingkreis startete. Ebenso war es möglich, ein Integrationsneuron (CA1-Pyramidenzelle) oder ein Echoneuron (CA3-Neuron) im Hippocampus direkt zu erregen. Drittens konnte man im Septum ein cholinerges Neuron erregen, welches - völlig abweichend vom bisherigen Konzept - die Körnerzellen oder die Pyramidenzellen des Hippocampus erregte. Ob dieser Weg in der Realität genutzt wird, mögen Neurologen abklären. Rein theoretisch steht er offen, bedingt aber die Ausbildung einer neuen Neuronenklasse, die im ursprünglichen Konzept fehlte. Er würde eine Mehrdeutigkeit in das System bringen, die eigentlich als Störung wirken würde.
Es gab jedenfalls mehrere Möglichkeiten, eine Signaloszillation im limbischen System zu starten oder auch zu beenden.
Skizze 7: Externer Start eines inaktiven Signals und externer Stopp eines aktiven Signals
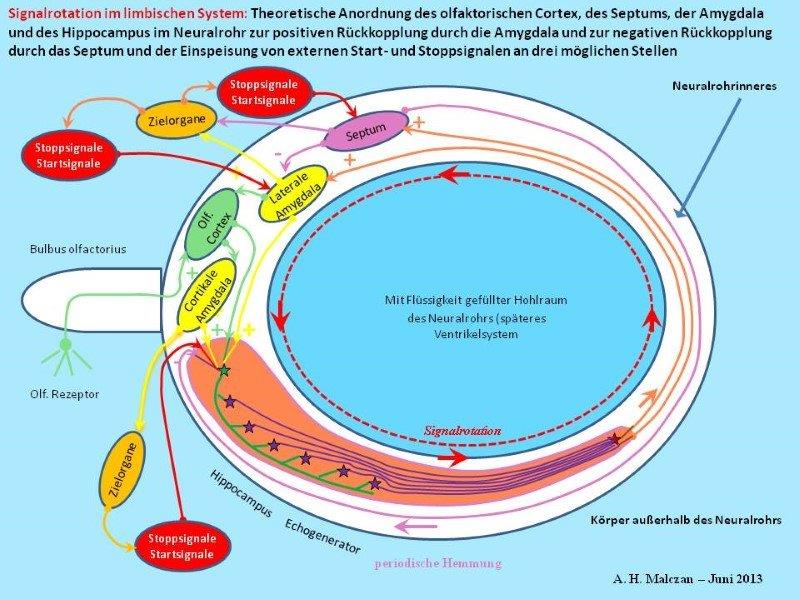
Eine Hauptaufgabe des oszillierenden Signals war es, die Erinnerung an das auslösende Inputsignal aufrechtzuerhalten. Man merkte sich sozusagen die Beute oder die Gefährdung für längere Zeit. Dieses Oszillationssignal steuerte während seiner Existenz vermittels seiner Aktionspotentiale die nötigen Muskelgruppen und andere Systeme des Körpers, um eine Reaktion auszuführen. Das Signal lag in einer Art Oszillationsform vor, es wurde also gespeichert. Aber es war keine statische Speicherung. Das Signal wurde nicht in einer neuronalen Speicherzelle eingespeichert, so wie dies zum Beispiel im Cerebellum geschieht und im Teil 2 dieser Monografie beschrieben wurde. Im limbischen System lag eine dynamische Speicherung durch Signalrotation vor. Während der Rotation bzw. Oszillation war das Signal präsent und aktiv, so als wäre der auslösende Reiz - z. B. der charakteristische Beuteduft - noch vorhanden. Oft war der reale Beuteduft bereits verblasst oder nicht mehr da, so dass das rotierende Signal und seine Aktionspotentiale nur die Erinnerung, also eine Beuteduft-Illusion schufen.
Auch heute noch ist eine Erinnerung letztlich nur eine geistige Vorstellung, also ebenfalls eine Illusion. Aber ohne diese Illusion gäbe es keine erinnerbare Vergangenheit, sondern nur die extrem kurze Gegenwart des Augenblicks. Insofern sind Gedächtnis und Illusion eng miteinander verwandt.
Im limbischen System dient die Signalrotation bzw. Signaloszillation der temporären, also vorläufigen Signalspeicherung. Das Verfahren der Benutzung von Stackspeichern kommt diesem Prinzip am nächsten. Daten, die man sich zwischenzeitlich merken will, steckt man in Computern in Stackspeicher, aus denen man sie später bei Bedarf herausholt. Im limbischen System wird ein solcher neuronaler Stackspeicher realisiert, indem die verschiedenen Daten in verschiedenen Kreisen rotierend herumgeschickt werden, in denen sie bis zum weiteren Gebrauch zunächst einmal aufgehoben sind. Und diese Signalrotation wird durch die damit verbundenen Schwingungen wahrnehmbar. Ein aktives Signal liegt also im limbischen System in einer Erscheinungsform vor, die wir in dieser Monografie als Oszillationsform bezeichnen. Während wir in Computern nur von den Speichern an sich sprechen, können wir bei neuronalen Systemen zwei Speicherarten unterschieden: Aktivspeicher und Passivspeicher. Das Speichern eines neuronalen Signals in einem Aktivspeicher führt zur ständigen Outputerzeugung. Die Speicherneuronen erzeugen also dauerhaft Aktionspotentiale. Erst die komplette Löschung der Signalrotation führt dazu, dass der ständige Output unterbleibt. Als Beispiel diene ein Pendel. Solange es schwingt, ist das Signal aktiv. Kommt das Pendel zum Stillstand, ist auch das repräsentierte Signal inaktiv.
Passivspeicher dagegen liefern keinerlei Output, wenn ein Signal eingespeichert wurde. Es verändern sich zwar die synaptischen Stärken der beteiligten Synapsen, aber die beteiligten Neuronen geben keinerlei Output ab. Diese Speicherform liegt im Cerebellum vor. Es gibt nur einen Fall, in dem ein Passivspeicher einen Output abgibt. Dazu muss er einen Input erhalten, der mit dem intern abgespeicherten Signal identisch ist oder ihm wenigstens sehr ähnlich ist. Dann, und nur dann liefert ein neuronaler Passivspeicher einen Output.
Ein neuronaler Passivspeicher vergleicht also den angelieferten Input mit dem intern abgespeicherten Wert. Sind beide identisch oder ähnlich, so liefert der Passivspeicher ein Outputsignal genau so lange, wie der Input mit dem gespeicherten Signal hinreichend übereinstimmt. Ähnlich arbeiten elektronische Passivspeicher in Computern.
Aber auch die Arbeitsweise von Computerspeichern bedarf einiger Erläuterungen, sind doch die Vorstellungen hierzu teils unzutreffend.
Ein Computerspeicher ist nicht unbedingt zu vergleichen mit einem Schrank voller Schubladen, in denen man verschiedene Dinge - z. B. Schrauben - deponiert. Eher mit einem gefüllten Fußballstadion oder einem gutbesuchtem Baumarkt. Plötzlich ertönt eine Lautsprecheransage: "Die Eltern von Fritzchen Müller aus Oranienburg mögen ihren fünfjährigen Sprössling am Eingang abholen!"
Prompt steht Vater Müller auf und rennt zum Eingang, wo das Söhnchen bereits wartet.
Ähnlich ist es bei Computerspeichern. Ein Adressensignal (quasi ein Namensaufruf) wird ausgesendet und erreicht über die Adressleitungen die Speicherzellen. Und genau jene Speicherzelle, deren Adresse auf den Adressleitungen aktiv ist, sendet ihren Speicherinhalt auf die Datenleitung. Man muss also vorher wissen, welche Speicherzelle den gesuchten Inhalt hat, und sie in die Anfrage einbeziehen. Die Anfrage zur Ermittlung der gespeicherten Daten lautet im Computer also sinngemäß: "Welchen Speicherinhalt hat die Speicherzelle mit der Adresse x?"
Computer kennen gegenwärtig nur Passivspeicher. Aktivspeicher mit Signaloszillation werden in gegenwärtigen Computern (im Jahre 2013) nicht verwendet.
Die Existenz von neuronalen Aktivspeichern und neuronalen Passivspeichern hat Konsequenzen für unser Bewusstsein. Das multimodale Abbild der Welt in unserem Kopf ist das Ergebnis der Aktivspeicher. Unsere Wahrnehmungen, Empfindungen, Vorstellungen, Gedanken und Gefühle werden durch Aktionspotentiale repräsentiert, die in Rotationsschleifen oszillieren und so als Signale miteinander wechselwirken.
Unser Lebenslauf dagegen ist in den Passivspeichern im Cerebellum eingelagert. Wäre er ständig aktiv, würden wir laufend einen imaginären Film sehen, der uns ständig das eigene Leben vorführt. Das wäre im normalen Leben echt hinderlich. Daher werden Erinnerungen, die wir gegenwärtig nicht benötigen, im Passivspeicher gelagert. Wie im Teil 2 dieser Monografie bereits beschrieben, werden Teile dieser inaktiven Daten dadurch aktiviert, dass das inverse Cerebellum mit seinem Output diese Daten in die Oszillationsform überführt und so den Aktivspeichern zuführt. Nur, wenn diese Daten zur Oszillation gebracht werden, erzeugen sie "erlebbare" Erinnerungen. Hier sei an das Beispiel des stürzenden Maurers erinnert, welches im Teil 2 dieser Monografie diskutiert wurde. Während der Maurer vom Baugerüst in die Tiefe stürzte, durchlebte er, den Tod vor Augen, in unzähligen, lebendigen Bildern seinen eigenen Lebenslauf. Dank einer glücklichen Fügung überlebte er den Sturz und konnte davon berichten. Sein inverses Cerebellum, aktiviert durch den Stress der Situation, lieferte diese Bilder zum Thalamus, der nicht unterscheiden kann zwischen externem Input der Außenwelt und selbsterzeugtem Input. Vom Thalamus fanden diese Signale Eingang ins nichtlimbische Oszillationssystem und wurden daher erlebbare Erinnerungen.
Wie im Teil 2 dieser Monografie gezeigt werden konnte, liegen auch die aktiven Signale im nichtlimbischen System in ihrer Oszillationsform vor, wenn die rezeptive Nachbarhemmung dies zulässt (Oszillationstheorem von Malczan).
Die rezeptive Hemmung der Pyramidenzellen im Hippocampus durch die GABAergen Interneuronen hatte neben den bereits genannten Aspekten noch eine weitere Wirkung. Wenn jedes hippocampale Outputneuron ein eigenes GABAerges Interneuron okkupierte und ausschließlich mit seinem eigenen Output erregte, so hemmte dieses Interneuron im Erregungsfalle alle in seinem größeren Einzugsgebiet erreichbaren Outputneuronen. Die gegenseitige Hemmung der Outputneuronen untereinander bezeichnen wir in dieser Monografie als rezeptive Nachbarhemmung. Sie sorgt dafür, dass sich von vielen Signalen nur die signalstärkeren durchsetzen. Räumlich benachbarte schwächere Signale werden durch die rezeptive Nachbarhemmung teilweise oder gar vollkommen unterdrückt.
Hier lag bereits die Möglichkeit für eine Fehlfunktion vor. Ein Ausfall der GABAergen Nachbarhemmung beraubte das Hippocampussystem der Möglichkeit, die Dauerschwingung durch kurze Pausen zu unterbrechen und schwächere Signale zu unterdrücken. Lawinenartiges Anschwellen der Aktivität führte dann im Hippocampus zu einem Zustand, der als Epilepsie bekannt ist. Epileptische Anfälle haben also eine mögliche schaltungstechnische Ursache im Ausfall der GABAergen Hemmung der Interneuronen im Hippocampus. Der Ausfall der GABAergen Septumneuronen hatte die gleiche Wirkung: die periodische Unterbrechung der hippocampalen Schwingung fiel weg, das System oszillierte pausenlos mit Höchstfrequenz. Also ebenfalls ein epileptischer Anfall. Die heftigen epileptischen Anfälle sind so gravierend, weil der überaktive Hippocampus seinerseits das Septum und die Amygdala extrem aktiviert, und beide die totale Aktivierung aller Systeme des Körpers bewirken.
Daher ist es einleuchtend, dass es alternativ eine hemmende, GABAerge Projektion aus dem Septum zur Amygdala gibt, damit die Amygdala ihrerseits auch für eine periodische Unterbrechung der möglichen Dauerschwingung sorgen kann, falls der Hippocampus dazu zeitweilig nicht fähig wäre. So war auch hier die Ausfallsicherheit gewährleistet ist, aber die Erkennung der eigentlichen Funktionsweise wurde erheblich erschwert.
Eine Besonderheit der rezeptiven Nachbarhemmung wurde bereits im Teil 2 dieser Monografie angesprochen und ermöglichte dort die Entstehung von Intelligenz und Denken: Die rezeptive Nachbarhemmung ist räumlich begrenzt. Kein GABAerges Interneuron kann ein Outputneuron hemmen, dessen Dendritenbaum es nicht erreicht. Das rezeptive Hemmungsfeld hat einen endlichen und meist kleinen Durchmesser. Dies hat Folgen für die Signale der höheren Assoziationsfelder. Diese Signale sind meist räumlich weiter voneinander entfernt. Durch das Potenzierungstheorem (siehe Monografie Teil 2) nimmt die Anzahl der Komplexsignale mit jeder Abstraktionsstufe zu und der räumliche Abstand der Neuronen dieser höheren Komplexsignale wird statistisch immer größer. Daher werden Komplexsignale der höheren Stufen des Gehirns, wenn sie einen Weg in den Hippocampus finden sollten, wesentlich längere Zeit - vielleicht Stunden oder Tage - im Hippocampussystem rotieren. Je abstrakter ein Signal ist, umso länger wird seine Verweildauer im Rotationssystem des Hippocampus sein, weil ähnliche und stärkere Signale statistisch unwahrscheinlicher sind und damit die rezeptive Nachbarhemmung kaum wirkt.
Ob solche höheren Komplexsignale den Hippocampus erreichen, wird später beantwortet werden.
Wegen der großen Bedeutung der getakteten tetanischen Schwingung im Hippocampus-Septum-Amygdala-System bezeichnen wir diese Schwingung künftig auch als limbischen Systemtakt. Die bereits gebräuchliche Bezeichnung "hippocampales Theta" wird dafür ebenfalls weiterverwendet.
Die Existenz einer periodischen, hochfrequenten Schwingung war wegbereitend für eine weitere Neuerung der Evolution. Höherfrequente neuronale Schwingungen werden von Neurologen gern als tetanische Erregungen bezeichnet. Eine tetanische Erregung ist aber eine wesentliche Voraussetzung für die Entstehung von LTP und LTD.
Langzeitpotenzierung und Langzeitdepression sind unabdingbar für die Entstehung von Langzeitgedächtnis. Bereits im Teil 1 und 2 dieser Monografie wurde gezeigt, wie LTP und LTD im Cerebellum zu Lernvorgängen führt. Es bleibt dieser Monografie noch vorbehalten, die Nutzung von LTP und LTD im limbischen System aufzuzeigen.
Nachdem erklärt wurde, wie Signale - und nicht nur olfaktorische - im limbischen System durch Signalrotation vorläufig - also temporär - gespeichert werden konnten, muss nun noch aufgezeigt werden, wie diese Signale in eine dauerhafte Speicherform überführt werden können. Dies bleibt dem Teil 4 dieser Monografie vorbehalten. Dort wird gezeigt werden, wie das Cerebellum die neuen limbischen Signale erlernen kann.
Am Ende dieses Exkurses in längst vergangene Epochen sollten wir noch Andeuten, wie es zur Entstehung des Papez-Kreises kam. Die aus dem Oszillationssystem des Hippocampus abgeleiteten Signale, welche die Erinnerung an die Beute oder an die Gefährdung durch Fressfeinde längere Zeit aufrecht erhalten sollten, wurden für die weitere Verarbeitung im Nervensystem benötigt. Einerseits wurde das septale System aktiviert. Andererseits erfolgte durch den Output der lateralen Amygdala eine starke Systemreaktion bei Angriff oder Flucht, während die zentrale Amygdala durch Hemmung der rotierenden Signale für ein Abebben der Erregungen sorgte.
Dieses limbische System schuf den ersten temporären Speicher im Gehirnsystem. Das angewandte Verfahren der Signaloszillation war so erfolgreich, dass nach und nach alle neuronalen Signale den Weg in das limbische System fanden.
Der Output dieser Teilsysteme, vor allem des Hippocampus, sammelte sich in einem neu entstehenden Umschaltkern, dem Corpus mamillare. Von dort zogen die Signale letztlich zum Nucleus anterior thalami, einem eigens für die limbische Signale neu geschaffenem Thalamuskern. Dieser projizierte in eine neue cortikale Struktur, den Gyrus cinguli. Diese Struktur ist ein Cortexgebiet, welches später vom neu entstehenden Cortex der modernen Wirbeltiere überdeckt wird und somit die innerste Gehirnwindung der heutigen Gehirne darstellt. Und da dieser Gyrus cinguli wiederum die Hauptmenge seines Outputs zum Hippocampus sendet, schließt sich auch hier der Kreis. Der kleine, innere limbische Schwingkreis, der aus Hippocampus, Septum und lateraler Amygdala besteht, und im dem die Signale durch Signalrotation - also auch Signaloszillation - temporär gespeichert werden, erhielt durch diese neuronale Konstruktion einen zusätzlichen, äußeren Schwingkreis. Dieser äußere limbische Schwingkreis, der aus der Ringschaltung von Hippocampus, dem anterioren Thalamus und dem Gyrus cinguli besteht, wird heute von den Neurologen als Papez-Kreis bezeichnet. Seine systemtheoretische und informationstheoretische Hauptaufgabe besteht nach Ansicht des Autors dieser Monografie in erster Linie in der temporären Speicherung der limbischen Signale durch Signaloszillation in geschlossenen Schleifen, so dass diese Signale dem Vergessen entrissen werden können.
Und während im inneren limbischen Schwingkreis vorwiegend die olfaktorischen Signale und die Signale des vegetativen Nervensystems rotieren, oszillieren im äußeren limbischen Schwingkreis diejenigen aktiven Signale, die nichtolfaktorischen Natur sind und einen Weg ins limbische System fanden. Es wird sich später zeigen, dass sich unter ihnen auch viele ungeprägte befinden. Ungeprägte Signale sind diejenigen, die das Cerebellum noch nicht komplett erlernen konnte. Nach der Prägung im Cerebellum erreichen solche Signale, wenn sie zwischen dem direkten und dem indirekten Cerebellum oszillieren (Siehe Oszillationstheorem von Malczan - Teil 2 dieser Monografie) über die zentrale Amygdala die laterale Amygdala und löschen dort die ursprünglichen Signale aus dem temporären, limbischen Rotationsspeicher. Daher rotieren im limbischen System nur ungeprägte Signale - genauer die aktiven Signale, die bisher nicht im Cerebellum erlernt worden sind. Und dies sind - ganz genau betrachtet - immer die neuen Signale des Lebewesens. Daher verbinden wir den Hippocampus, aber auch die Amygdala immer mit neuen Signalen, denn erlernte Signale wählen das nichtlimbische Oszillationssystem für ihre Aktivitätsphasen aus. Der Verlust der Funktionsfähigkeit des limbischen Systems ist gleichbedeutend mit dem Verlust der Lernfähigkeit für neue Signale. Dies müssten, damit sie erlernt werden können, zunächst in der limbischen Schleife hinreichend lange rotieren, um all diejenigen Neuronen aus vorhandenen Proneuronen zu rekrutieren, die für die Abspeicherung im cerebellaren System vonnöten sind. Und diese Umwandlung der Proneuronen und die Ausbildung entsprechender Axone zwischen ihnen dauert halt Stunden oder Tage. Ist sie unmöglich, geht die Lernfähigkeit verloren.
Die Signaloszillation - die wir auch im nichtlimbischen System beobachten (Siehe Oszillationstheorem von Malczan - Teil 2 der Monografie) - sollte ganz emotionslos betrachtet werden. Zwar verbinden wir die limbischen Signale stets mit Emotionen und Gefühlen. Dies liegt jedoch an der Bedeutung der Signale, die z. B. von der Amygdala für Kampf oder Flucht bewertet werden müssen. Die kontextbezogene und emotionale Bedeutung der Signale des limbischen Systems darf nicht von der eigentlichen Aufgabe ablenken, die die Evolution dem limbischen System als Auftrag mitgab: Die Bewahrung von bedeutsamen Signalen über einen hinreichend langen Zeitraum. Das limbische System erschuf das erste Gedächtnis der Evolution, das durch eine neuronale Schaltung hervorgebracht wurde.
Dieses Konzept, eine Signalform durch Oszillation in einer geschlossenen Signalschleife temporär zu speichern, war so erfolgreich, dass es im späteren Verlauf der Evolution ebenfalls im nichtlimbischen System eingesetzt wurde und dort zur Entstehung von Intelligenz und Denken führte, wie im zweiten Teil dieser Monografie bereits gezeigt werden konnte.
Es ist daher an der Zeit, diese Theorie genauestens zu prüfen. Die Überprüfung der eigenen Theorie durch den Autor brachte einige Fehler zutage, die nachfolgend (im Teil 4 und 5 dieser Monografie) korrigiert werden müssen. Dies betrifft insbesondere die doppelte und die vierfache Negation im System der Basalganglien. Hier warten neue, korrigierte Einsichten auf uns, die den Weg freimachen für das Verständnis der digitalen Arbeitsweise des Gehirns.
Insgesamt lässt sich feststellen, dass durch die Nutzung des limbischen Systems und des Signalrotationsverfahrens jedes aktive Signal unterbrechbar sein musste. Hunger förderte die Beutesuche, aber die Sattheit stoppte sie. Analog bildeten sich nun Signalpaare, bei denen beide Signalpartner zueinander invers, also gegenteilig waren. Komplementäre Signale sozusagen. Hunger/Sattheit, Lust/Unlust, schmackhaft/ekelig, warm/kalt, Angriff/Flucht, Mut/Angst, Liebe/Hass, zu fast jedem limbischen Signal gab es einen komplementären Signalpartner, der quasi das Gegenteil bedeutete. Und ein aktives Signal konnte nur durch sein komplementäres Signal gestoppt werden, wobei dann das komplementäre Signal zum aktiven Signal wurde. Von zwei zueinander komplementären Signalen war daher immer eines aktiv, das andere inaktiv. Dadurch war das System gewissermaßen dual, also zweiwertig. Und weil es sehr viele solcher komplementären, also auch dualen Signale gab, lebte man in einer vieldimensionalen dualen Welt. Daher interpretieren wir das limbische System selbst als ein multimodales Bewertungssystem. Und weil viele der Signale sehr komplexer Natur sind, also aus sehr vielen Subelementen bestehen, deuten wir die limbischen Signale oft als Gefühle. Zu komplex sind die Elementarsignale, die in ihnen verborgen sind. Aber zu jedem realen Gefühl gibt es im limbischen System ein komplementäres Gefühl, welches quasi sein reines Gegenteil ist. Und immer ist nur eines der beiden aktiv.
Komplizierter wird es erst richtig, wenn die Stärke dieser Gefühle messbar wird, weil das limbische System irgendwann die Fähigkeit erlangte, limbische Signale zu digitalisieren. Da gab es plötzlich nicht mehr nur Ja oder Nein, sondern alle Zwischenstufen. Das mag unlogisch erscheinen. Aber die Fragen "Ist dir warm?", "Hast du Hunger?", "Geht es dir gut?" sind nicht nur mit Ja oder Nein beantwortbar, sondern auch mit Zwischenwerten. "Mir ist sehr warm", "Mir ist etwas warm" ,"Mir ist leicht kalt". Wir alle kennen den Satz: "Die Regen-wahrscheinlichkeit beträgt 45 %". Prozentangabe sind klassische Zwischenwertangaben. Spätestens mit der Einführung limbischer Zwischenwerte ins bisher duale Raster entsteht eine vieldimensionale, digitale, aber dennoch nur scheinkontinuierliche Welt. Denn eine endliche Neuronenmenge kann nur endlich viele Interpolationswerte als Zwischenwerte bilden. Die scheinbare Kontinuität der Welt und ihrer Parameter ist eine neuronale Illusion des sie wahrnehmenden Geistes. Die Welt ist zwar meist kontinuierlich (wenn man sie nicht gerade vom Standpunkt eines Quantenphysikers betrachtet), kann aber wegen der endlichen Neuronenmenge des Gehirns nur diskontinuierlich, quasi digitalisiert, abgebildet werden. Das bisher ungelöste Geheimnis, wie die kontinuierlichen Umweltsignale im Gehirn digitalisiert werden, soll im Teil 4 dieser Monografie erstmals aufgezeigt werden.
Bevor wir nun die gewonnenen Einsichten zusammenfassen, möge noch eine einfache Frage zum limbischen System beantwortet werden. Wie viele verschiedene limbische Signale gibt es ungefähr beim Menschen?
Gehen wir davon aus, dass die meisten dieser Signale im Aktivitätsfall auch im äußeren limbischen Schwingkreis - dem Papez-Kreis - rotieren, so gibt es bereits seit langer Zeit eine Antwort darauf. Zu jedem dieser Signale gehört ein Projektionsneuron im Corpus mamillare. Und bereits im Jahre 1957 ermittelten Powell, Guillery und Cowan, dass es im Nucleus medialis des Corpus mamillare des Menschen etwa 400000 Nervenzellen gibt. Nachzulesen in dem überaus aktuellem Werk "Das Zentralnervensystem in Zahlen und Tabellen" von Blinkow/Glezer auf Seite 147 und Tabelle 163 auf Seite 333. Damit könnte ein Mensch etwa 400000 verschiedene limbische Signale erlernen und unterschieden. Wobei das limbische System doppelt vorhanden ist.
ISBN
978-3-00-037458-6
ISBN 978-3-00-042153-2
Monografie von Dr. rer. nat. Andreas Heinrich Malczan