Gehirntheorie der Wirbeltiere
ISBN
978-3-00-064888-5
Monografie von Dr. rer. nat. Andreas Heinrich Malczan
6 Die Weiterentwicklung des Striatums und des Basalgangliensystems infolge der Signaldivergenz im Cortex
6.1 Die Nutzung hemmender Inversionsneuronen zur Bewegungserkennung
Das Vestibulo- und das Spinocerebellum nutzten als wesentliches Arbeitsprinzip die Signalinversion an dauererregten Neuronen. Das zu invertierende Signal erreichte über die Kletterfaser die Purkinjezelle, die es auf hemmende Transmitter umschaltete. Dieses Signal hemmte im Kleinhirnkern ein dauererregtes Neuron. Dessen Dauererregung entstammte der Formatio reticularis. Die Hemmung war relativ, sie nahm mit der Feuerrate zu. Genau dies war die Signalinversion. Weil das dauererregte Neuron im Kleinhirnkern den Transmitter Glutamat verwendete, war das invertierte Signal erregend. Der Output des Kleinhirnkerns war der invertierte Output des Nucleus ruber und diente der motorischen Ansteuerung der Gegenseite.
Zu einer bedeutenden Weiterentwicklung im Nervensystem der künftigen Wirbeltiere kam es, als dauererregte Neuronen zur Signalinversion genutzt wurden, die einen hemmenden Transmitter verwendeten. Dies trat bei GABAergen Neuronen auf. Derartige Inversionsneurone finden wir beispielsweise in der Matrix des Striatums, im Globus pallidus, aber auch in der Amygdala.
Die an vielen Stellen des Wirbeltiergehirns anzutreffenden hemmenden Inversionsneuronen weisen (so der Autor) eine gemeinsame Entstehungsgeschichte auf, die im folgenden Theorem zusammengefasst wird.
Theorem der Entstehung von hemmenden Inversionsneuronen
Hemmende Inversionsneuronen dienen der Signalinversion von Signalen.
Sie entstehen als Abkömmlinge von hemmenden Interneuronen, die ursprünglich der lateralen Hemmung, also der Kontrastverstärkung dienten.
Sie empfangen eine Dauererregung, entweder von erregenden Axonen, die an ihnen vorbeiziehen und sie dabei kontaktierten (z. B. Striatum), oder ihnen wird aus einem Mittelwertkern eine Dauererregung zugeführt (z. B. Globus pallidus).
Sie empfangen weiterhin ein hemmendes Inputsignal. Dieses hemmt sie nur relativ. Mit zunehmender Signalstärke dieses Signals wächst die Hemmungswirkung.
Die relative Hemmung der vorhandenen Dauererregung führte zur Signalinversion des Inputsignals.
Erinnert sei hier an das Theorem der Bewegungserkennung durch das Urstriatum. Dopaminerge Neuronen empfingen den cortikalen Output der Klassen 5 und 6 der ersten Etage des Strickleiter-Nervensystems und erregten die Striosomenneuronen im Striatum. Diese Neuronen projizierten hemmend in den Nucleus ruber. Dieser frühe Tractus tegmentalis centralis, selbst wenn er nur aus ganz wenigen Neuronen bestand, ermöglichte bereits eine Bewegungserkennung und die Wahrnehmung von Veränderungen. Die erregenden Gegenwartssignale und die hemmenden, zeitverzögerten Vergangenheitssignale erschufen eine Differenzabbildung, die zeitselektiv war.
Im Cortex hatte sich inzwischen - in einem langen Entwicklungsweg - die Signaldivergenz der Signalklasse 3 etabliert. Jedes cortikale Inputneuron der Klasse 4 projizierte auf eine Unmenge von Neuronen der Klasse 3. Als Folge kam es zu einer enormen Ausdehnung der Cortexoberfläche, so dass durch Raummangel sogar eine Faltenbildung auftrat, mit der die Oberfläche zusätzlich vergrößert werden konnte.
Diese neuen, durch starke Signaldivergenz erzeugten Signale mussten in den Mittelwertsystemen ebenso berücksichtigt werden wie die bisherigen. Die Axone der Neuronen der Klasse 3 wurden letztlich so behandelt wie die der Klassen 5 und 6. Sie projizierten ebenfalls in die Substantia nigra pars compacta. Dort wurde jedes Axon unter Beibehaltung der Feuerrate wieder auf Dopamin umgeschaltet und in Richtung des Striatums zurückgeschickt, um dort ein GABAerges Striatumneuron zu kontaktieren.
Im Striatum selbst gab es jedoch eine Weiterentwicklung. Die GABAergen Striosomenneuronen verwendeten den Dopaminrezeptor D2. Im Striatum der heutigen Wirbeltiere existiert zusätzlich der Dopaminrezeptor D1. Es muss also in früher Urzeit ebenfalls derartige Rezeptoren bei den Striatumneuronen gegeben haben. Wir unterstellen daher die Entwicklung von Striatumneuronen, die den Dopaminrezeptor D1 besaßen. Neuronen mit dem Dopaminrezeptor D1 werden durch Dopamin gehemmt. Die neue Klasse der Striatumneuronen mit dem Dopaminrezeptor D1 bildete eine neue Struktur, die als Matrix bezeichnet wird.
Die Matrixneuronen entwickelten sich zu hemmenden Inversionsneuronen. Sie bildeten große Dendritenbäume, mit denen sie die Erregung der durch ihr Gebiet hindurchziehenden Cortexaxone der Klasse 5 zu einer tonischen Dauererregung integrierten.
Theorem der tonischen Erregung der Matrixneuronen
Den Matrixneuronen wurde durch die hindurchziehenden Cortexsignale der Klasse 5 eine Dauererregung aufgezwungen.
Zu jedem Matrixneuron existierte genau ein zugeordnetes Cortexneuron der Klasse 3, welches erregend in die Substantia nigra pars compacta projizierte. Dort wurde das Cortexsignal auf Dopamin umgeschaltet und zum zugeordneten Matrixneuron zurückgeschickt, um es zu hemmen. Dies entsprach der Inversion des Cortexsignals.
Theorem der Matrix des Striatums als Inversionskern
Die Matrix des Striatums ist ein Inversionskern, der das zur Inversion erforderliche Mittelwertsignal aus dem hindurchziehenden Cortexoutput der Klasse 5 gewinnt. Invertiert wird der Cortexoutput der Neuronen der Klasse 3 in einer Punkt-zu-Punkt-Abbildung, nachdem dieser zunächst auf dem Umweg zur Substantia nigra pars compacta auf Dopamin umgeschaltet wurde und dieser Umweg eine Zeitverzögerung hervorrief.
Theorem des Matrixoutputs des frühen Striatums
Der Output der Matrix des frühen Striatums einer Urhirnhälfte war der invertierte, zeitverzögerte und auf GABA umgeschaltete Cortexoutput der dritten Schicht der gleichen Urhirnhälfte.
Nach dieser Erweiterung stellte das Striatum ein doppeltes Körpermodell des Cortex dar. Die Striosomen waren ein zeitverzögertes Mittelwertmodell der Klasse 6 und ein zeitverzögertes Signalmodell der Klasse 5, während die Matrix ein inverses und zeitverzögertes Signalmodell der Neuronen der Klasse 3 darstellte. Alle drei Modelle verwendeten den hemmenden Transmitter GABA.
Die ursprüngliche Aufgabe des Striatums, eine zeitsensitive Differenzabbildung für die Bewegungsanalyse zu bilden, war mit den Matrixsignalen so nicht erreichbar. Der Cortexoutput wurde zwar auf GABA umgeschaltet, jedoch war er einmal invertiert worden.
Die Signale der Neuronen der Klasse 3 waren jedoch extremwertcodiert. Grund dafür war die nichtlineare Signaldämpfung auf marklosen Axonen, die die Inputerregung auf die vielen Outputneuronen der Klasse 3 verteilten.
Falls diese Signale im Cortex minimumcodiert waren, so lagen sie im Striatum in maximumcodierter Form vor. Waren sie jedoch im Cortex maximumcodiert, so lagen sie im Striatum in minimumcodierter Form vor. Egal, ob sie im Cortex minimumcodiert oder maximumcodiert vorlagen, nun hatten sie im Striatum die entgegengesetzte Codierung. Nur eine zweite Inversion konnte daraus wieder Signale erzeugen, die für eine Differenzabbildung geeignet waren. Die Lösung hierfür war jedoch bereits verfügbar.
Die Axone der Matrixneuronen zogen, ebenso wie die Axone der Cortexneuronen der Klasse 5 und 6, abwärts in Richtung Nucleus ruber. Auf ihrem Weg kamen sie am Mittelwertkern der thalamischen Etage vorbei, der vom Nucleus subthalamicus gebildet wurde. Dessen Neuronen waren ein Mittelwertmodell der cortikalen Etage und tonisch erregt (wenn genügend cortikale Signale vorhanden waren).
Innerhalb des Nucleus subthalamicus gab es ebenso hemmende Interneuronen. Sie empfingen den Input dieses Kerns und sorgten für eine laterale Hemmung, also eine Kontrastverstärkung in diesem Mittelwertkern.
Wir postulieren, dass die GABAergen Matrixneuronen kompatibel mit diesen hemmenden Interneuronen waren, sie verwendeten den gleichen Transmitter. Daher kam es zu synaptischen kontakten. Die Matrixneuronen hemmten diese Interneuronen. Diese empfingen jedoch auch einen erregenden Zustrom aus den glutamatergen Neuronen des Nucleus subthalamicus. Je stärker die gabaerge Kopplung zu den Matrixaxonen wurde, umso stärker wurde auch ihre Kopplung zu den glutamatergen Axonen, die ja eine tonische Mittelwerterregung darstellten. Diese hemmenden Neuronen formten sich zu einem selbständigen Kern, der als Globus pallidus bezeichnet wird. Seine Projektionsaxone suchten den Weg, aus dem ihre Erregung kam und zogen aufwärts, wo sie in der thalamischen Etage einmündeten und dortige Neuronen kontaktierten. Die Axone des Globus pallidus endeten also nicht im Nucleus ruber, dazu war ihre Anzahl offenbar zu groß. Sie zogen zum signalverwandten Thalamus. Der Thalamus im Strickleitersystem bestand aus dem sensorischen und dem motorischen Zentrum. Die Axone des Globus pallidus zogen zur motorischen Seite, dort trafen auch alle Cortexaxone der Neuronen der Klasse 3 ein. Mit diesen vereinten sie sich in einer Punkt-zu-Punkt-Abbildung und bildeten die zeitsensitive Differenzabbildung.
Theorem der Entstehung des Globus pallidus
Der Globus pallidus ist ein Abkömmling der hemmenden Interneuronen des Nucleus subthalamicus, die dort für die laterale Hemmung, also die Kontrastverstärkung sorgten. Sie empfangen die tonische Dauererregung aus diesem Kern und werden von den Matrixneuronen des Striatums gehemmt, so dass sie die Matrixsignale invertieren. Sie projizieren in thalamische Kerne, in die sie den hemmenden Anteil zu einer zeitsensitiven Differenzabbildung liefern.
Damit hatte sich folgender Algorithmus etabliert:
- Jedes Cortexneuron der Klasse 3 projizierte in ein Neuron der Substantia nigra pars compacta.
- Dieses dopaminerge Neuron schaltete das cortikale Signal auf den Transmitter Dopamin um und projizierte in genau ein Matrixneuron des Striatums, wobei der lange Weg eine Zeitverzögerung verursachte.
- Dieses Matrixneuron wurde einerseits tonisch erregt, da es die durch das Striatum hindurchlaufenden Axone der cortikalen Neuronen anzapfte.
- Gleichzeitig wurde es vom eintreffenden dopaminergen Signal gehemmt.
- Dies entsprach einer Signalinversion. Das Outputsignal des Matrixneurons war also das invertierte und auf GABA umgeschaltete Cortexsignal des zugehörigen Cortexneurons der Klasse 3.
- Das Matrixaxon erreichte ein zugeordnetes Neuron im Globus pallidus. Dieses war dauererregt durch den Zustrom der Mittelwertsignale aus den Nucleus subthalamicus. Diese Dauererregung wurde vom Matrixaxon gehemmt. Dies entsprach einer zweiten Signalinversion.
- Der Output des Globus pallidus war also das doppelt invertierte Signal aus dem zugehörigen Cortexneuron.
- Da eine doppelte Signalinversion wieder das Ursprungssignal ergibt, entsprach der Output des Neurons im Globus pallidus dem ursprünglichen Cortexsignal, war jedoch wegen der Transmitterumschaltung auf GABA hemmend.
- Das Basalgangliensystem aus Striatum, Globus pallidus, Substantia nigra pars compacta und Nucleus subthalamicus bewirkte für jedes Cortexneuron der Klasse 3 die Umschaltung seines Signals auf den Transmitter GABA, die dabei vorgenommenen zwei Signalinversionen hoben sich in ihrer Wirkung auf. Auf dem langen Signalweg wurde das ursprüngliche Cortexsignal jedoch stärker zeitverzögert.
Theorem des erweiterten Basalgangliensystems
Der Output des Globus pallidus war der zeitverzögerte und auf den hemmenden Transmitter umgeschaltete Cortexoutput der Neuronen der Klasse 3.
Nun stand der Bildung einer zeitsensitiven Differenzabbildung nichts mehr im Wege. Denn der Cortex projizierte absteigend in den motorischen Thalamus, dort lagen alle Signale der Klasse 3 in erregender Form vor.
Wenn der Globus pallidus in einer Punkt-zu-Punkt-Abbildung wieder in diesen Thalamus projizierte, so gab es in jedem Thalamusneuron ein erregendes Signal und das aus ihm gewonnene zeitverzögerte und hemmende Signal aus dem Globus pallidus. So wurde der Thalamus - überall wo er gleichzeitig vom Cortex und vom Globus pallidus beliefert wurde - zu einer zeitsensitiven Differenzschaltung und konnte Bewegungen und Signalstärkeveränderungen detektieren. Sein Output war ein Ergebnis der Bewegungs- und Veränderungsanalyse.
Und da diese Thalamusregionen ebenfalls zum Cortex projizierten, konnten im Cortex Assoziationsgebiete entstehen, die Bewegungen und Signalstärkeveränderungen analysierten. Damit war die ursprüngliche Bewegungsanalyse bezüglich der Signalklasse 5 im Nucleus ruber durch eine zusätzliche im Thalamus ergänzt worden, die die Signale der divergenten Signalklasse 3 auswertete.
Nicht alle Thalamusgebiete dienen der Bewegungsanalyse. Die Analyse der Axonverbindungen im Gehirn von Wirbeltieren ergibt, dass der Nucleus centromedianus und der Nucleus ventralis (seit Urzeiten) der Bewegungsanalyse dienen.
Theorem der thalamischen zeitsensitiven Differenzabbildung zur Bewegungserkennung
Im Nucleus centromedianus und im ventralen Thalamus überlappen sich der erregende thalamische Input, der zum Cortex zieht, mit den vom Globus pallidus zurückgelieferten, zeitverzögerten und auf GABA umgeschalteten Cortexsignalen in einer Punkt-zu-Punkt-Abbildung und erzeugen eine zeitsensitive Differenzabbildung, die Bewegungen und Signalstärkeveränderungen analysieren kann. Dieser thalamische Output speist die cortikalen Assoziationsgebiete, die für die Bewegungsanalyse der verschiedensten Modalitäten zuständig sind.
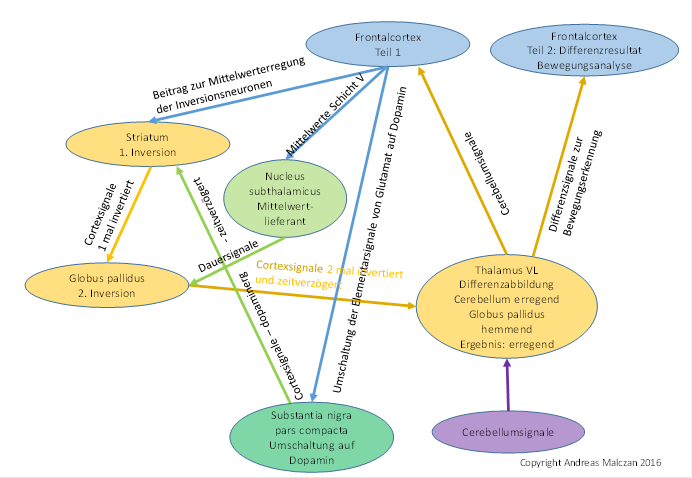
Abbildung 73 - Signalinversion in den Basalganglien zur Erzeugung einer zeitsensitiven Differenzabbildung im Thalamus VL
Zu beachten ist, dass der Thalamus VL funktionell zweigeteilt sein muss. Eine Hälfte sendet den Output zum Frontalcortex und zur zweiten Hälfte dieses Thalamuskerns. Letztere empfängt nun zusätzlich die hemmenden Signale des Globus pallidus und bildet durch punktweise Überlagerung die Differenzabbildung, die ihrerseits im Frontalcortex neue Assoziationsgebiete erreicht.
Bei höheren Wirbeltieren ist das thalamische Putamen (vermutlich) für die optische Bewegungsanalyse zuständig, während der ventrale Thalamus mehr für die motorische Bewegungskontrolle zuständig ist.
Es sei vorsorglich darauf hingewiesen, dass der Globus pallidus sich im Rahmen einer Funktionserweiterung des Cerebellums nochmals teilen sollte und daraus zwei selbständige Kerne hervorgehen würden, die als innerer und äußerer Pallidus bezeichnet werden. In diesem Zusammenhang ging auch die 1:1-Projektion im Striatum verloren, so dass (bei den höheren Säugetieren) ein Neuron der Substantia nigra pars compacta in eine ganze Kette von Striatumneuronen projizierte. Diese Entwicklung war hier noch in weiter Ferne. Sie begann jedoch damit, dass der Output des Cerebellums den Weg ins Cerebellum fand. So konnte das Pontocerebellum entstehen, welches die cortikalen Signale einem weiteren Auswertungsalgorithmus unterzog und die Fähigkeit zur Entwicklung einer überdurchschnittlichen Intelligenz bescherte.
Die Kompartimentierung des Striatums in die Matrix und die Striosomen hatte einen unerwarteten Nebeneffekt, der jedoch aus signaltheoretischen Gesichtspunkten vorhersehbar war. Die Striosomen repräsentierten zum großen Teil die Signalklasse 5, die Matrix die Signalklasse 3. Letztere ging durch starke Signaldivergenz aus der Klasse 5 hervor. Hier konnte die Signaldivergenz wieder rückgängig gemacht werden, wenn die Matrix wieder auf die Striosomen projizieren würde. Indirekt ist solch ein Effekt zu beobachten. Die dopaminergen Axone erreichen in der Matrix nicht nur die Matrixneuronen, sondern erregen zusätzlich lokale Interneuronen, die den Transmitter Acetylcholin verwenden und erregend in die Striosomenneuronen projizieren. Diese Projektion stellt die Signalkonvergenz der Signalklasse 3 auf die Signalklasse 5 wieder her.
Die nachfolgende Abbildung verdeutlicht die Signalverarbeitungsalgorithmen im Basalgangliensystem und hebt insbesondere die Divergenz und die Konvergenz der Signale hervor.
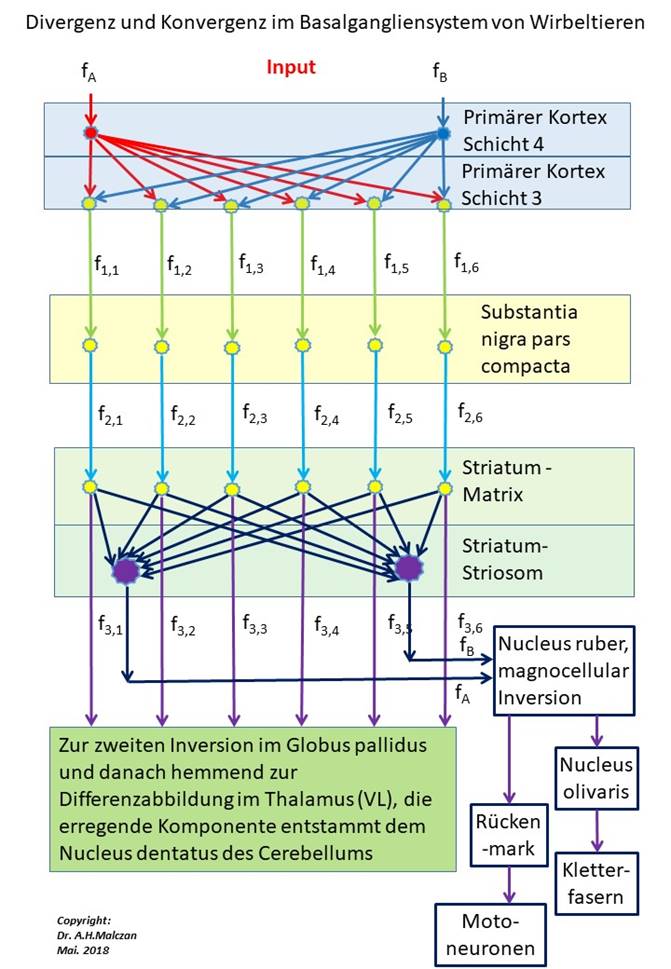
Abbildung 74 - Divergenz und Konvergenz im Basalgangliensystem
Die dopaminergen Axone der Klasse 3, die die Matrixneuronen hemmen, erregen über Kollateralen cholinerge Interneuronen, die sich im Matrixraum verteilen. Diese Interneuronen übernehmen die Erregung und projizieren ihrerseits erregend in die Striosomenneuronen. So wird die ursprüngliche, cortikale Signaldivergenz der Klasse 5 auf die Klasse 3 rückgängig gemacht, weil nun die dopaminergen Axone der Klasse 3 der Matrix auf die Striosomenklasse 5 projizieren.
Diese Projektion wird indirekt über die cholinergen Interneuronen vermittelt, die den Transmitter Acetylcholin besitzen. Bei Untersuchungen der Struktur des Striatums wurde die Kompartimentierung an der ungleichen Verteilung des Transmitters ACH nachgewiesen.
Theorem der Signalkonvergenz der Matrixsignale auf die Striatumsignale
Die dopaminergen Axone, die die Signale der Cortexneuronen der Klasse 3 zur Matrix transportieren, erregen cholinerge Interneuronen, die ihrerseits die Striosomenneuronen erregen. So wird die cortikale Signaldivergenz durch eine striatale Signalkonvergenz rückgängig gemacht und die Signale der Klasse 5 aus den Signalen der Klasse 3 zurückgewonnen, um im Nucleus ruber die ursprüngliche zeitsensitive Differenzabbildung weiterhin mit Signalen zu versorgen.
Die ursprüngliche zeitsensitive Differenzabbildung im Nucleus ruber blieb den Wirbeltieren also erhalten, zusätzlich verfügten sie nun über eine viel sensiblere Differenzabbildung im ventralen Thalamus, die auf den über Divergenz gewonnenen extremwertcodierten Signalen der Klasse 3 beruhte. Dies hatte Folgen für die Signale der Klassen 3, 5 und 6, die im Basalgangliensystem ausgewertet wurden. Die aus der Klasse 3 abgeleiteten Signale endeten als hemmender Output des Globus pallidus im ventralen Thalamus und überlagerten sich dort mit den eintreffenden erregenden Signalen zu einer zeitsensitiven Differenzabbildung. Die aus der Klasse 5 abgeleiteten Signale endeten ebenso hemmend im Nucleus ruber für die dortige Differenzabbildung. Die aus den Mittelwertsignalen der Klasse 6 abgeleiteten Signale erreichten den Nucleus ruber, fanden dort jedoch keine kompatiblen Partner vor. Sie wurden an den Nucleus olivaris übergeben und trafen über die Kletterfasern in dem Teil des Cerebellums ein, der sich zum Pontocerebellum entwickelte.
Da die Ausgangssignale dieser Kletterfaserprojektion von den cortikalen Mittelwertneuronen der Klasse 6 abstammten, die über das Striatum in den Nucleus ruber und zum kontralateralen Cerebellum projizierten, bezeichnen wir diese Kletterfaserklasse als die Mittelwertkletterfasern. Sie wurde im Kapitel über das Pontocerebellum ausführlicher betrachtet.
Theorem der Mittelwertkletterfasern
Die cortikale Projektion der Mittelwertneuronen der Klasse 6 über die Substantia nigra pars compacta zu den Striosomen des Striatums und von dort über den Nucleus ruber zum Nucleus olivaris bezeichnen wir als die Mittelwertprojektion ins Kletterfasersystem, die zugehörigen Kletterfasern bezeichnen wir als Mittelwertkletterfasern. Sie enden im Pontocerebellum an den Purkinjezellen, jedoch werden von ihnen auch die Kleinhirnkerne und die Interneuronen des Cerebellums kontaktiert.
Diese Projektion ist verantwortlich für die Lernfähigkeit des Cerebellums, wie in dieser Monografie gezeigt wurde. In diesem Zusammenhang ist die Synchronisation der verschiedenen Mittelwertsignale in der Substantia nigra pars compacta bedeutungsvoll. Die tetanischen Schwingungen der verschiedenen Mittelwerte, die von kurzen Pausen unterbrochen wird, werden dahingehend synchronisiert, dass die auftretenden Pausen in etwa zeitgleich auftreten und eine Frequenz von 2 bis 5 Hz besitzen. Pro Sekunde gibt es also bei den Mittelwertschwingungen 2 bis 5 Pausen, die zeitlich synchronisiert werden. Dies ist bedeutsam für die Funktionsweise des Pontocerebellums.
- ← 5.10 Der Körperseitenvergleich in Differenzabbildungen
- 6.2 Die zeitsensitive Differenzabbildung im Nucleus centromedianus →